网址:http://m.1010jiajiao.com/timu3_id_432003[举报]
回答下列问题:
(1)F元素在周期表中的位置为
(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式




(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:
回答下列问题:
(1)F元素在周期表中的位置为______,F原子基态时核外电子排布式______.
(2)甲、乙均能与水反应,但甲与水发生的反应属于氧化还原反应,写出甲的电子式______,写出甲与水发生反应的化学方程式并标出电子转移的方向和数目:______.
(3)F的一种红褐色氢氧化物与E的单质、B的最高价氧化物对应的水化物三种物质作用可生成一种净水剂B2FA4,试写出该反应的化学反应方程式为:______.
查看习题详情和答案>>
A 、B、C、D、E、F、G是元素周期表中1~36号的七种常见元素,其原子序数依次增大。其中B、D、G三种元素的原子核外未成对电子数均等于其周期序数;F的单质常用于工业上制漂白粉;D与A、E均可形成原子个数比为1:1和1:2的化合物。
、B、C、D、E、F、G是元素周期表中1~36号的七种常见元素,其原子序数依次增大。其中B、D、G三种元素的原子核外未成对电子数均等于其周期序数;F的单质常用于工业上制漂白粉;D与A、E均可形成原子个数比为1:1和1:2的化合物。
请回答下列问题:
⑴F在元素周期表中的位置_____ ________,B、C、D、E元素第一电离能由大到小的顺序是____________(用元素符号表示);
________,B、C、D、E元素第一电离能由大到小的顺序是____________(用元素符号表示);
⑵F、G两元素的单质间反应所得产物为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醇,丙酮等有机溶剂。据此判断该产物晶体为______晶体;该产物中G元素相应价态离子的核外电子排布式为__________________;
⑶B、C、D均可与A形成10电子和18电子的分子。
①在B、C、D分别与A形成的10电子分子中,极性最强的共价键是______ (用化学键表示)。A、B、C 三元素形成的最简单分子中
三元素形成的最简单分子中 键与
键与 键个数比为______;
键个数比为______;
②C、D分别与A形成的18电子分子X、Y可用作火箭推进剂。已知16g液态X与足量液态Y充分反应生成一种液态化合物和一种气态单质,并放出838kJ的热量,试写出X与Y反应的热化学方程式________________________。
A、B、C、D、E、F、G是元素周期表中1~36号的七种常见元素,其原子序数依次增大.其中B、D、G三种元素的原子核外未成对电子数均等于其周期序数;F的单质常用于工业上制漂白粉;D与A、E均可形成原子个数比为1:1和1:2的化合物.
请回答下列问题:
(1)F在元素周期表中的位置________,B、C、D、E元素第一电离能由大到小的顺序是________(用元素符号表示);
(2)F、G两元素的单质间反应所得产物为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醇,丙酮等有机溶剂.据此判断该产物晶体为________晶体;该产物中G元素相应价态离子的核外电子排布式为________;
(3)B、C、D均可与A形成10电子和18电子的分子.
①在B、C、D分别与A形成的10电子分子中,极性最强的共价键是________(用化学键表示).A、B、C三元素形成的最简单分子中σ键与π键个数比为________;
②C、D分别与A形成的18电子分子X、Y可用作火箭推进剂.已知16 g液态X与足量液态Y充分反应生成一种液态化合物和一种气态单质,并放出838 kJ的热量,试写出X与Y反应的热化学方程式________.
 、B、C、D、E、F、G是元素周期表中1~36号的七种常见元素,其原子序数依次增大。其中B、D、G三种元素的原子核外未成对电子数均等于其周期序数;F的单质常用于工业上制漂白粉;D与A、E均可形成原子个数比为1:1和1:2的化合物。
、B、C、D、E、F、G是元素周期表中1~36号的七种常见元素,其原子序数依次增大。其中B、D、G三种元素的原子核外未成对电子数均等于其周期序数;F的单质常用于工业上制漂白粉;D与A、E均可形成原子个数比为1:1和1:2的化合物。请回答下列问题:
⑴F在元素周期表中的位置_____
 ________,B、C、D、E元素第一电离能由大到小的顺序是____________(用元素符号表示);
________,B、C、D、E元素第一电离能由大到小的顺序是____________(用元素符号表示);⑵F、G两元素的单质间反应所得产物为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醇,丙酮等有机溶剂。据此判断该产物晶体为______晶体;该产物中G元素相应价态离子的核外电子排布式为__________________;
⑶B、C、D均可与A形成10电子和18电子的分子。
①在B、C、D分别与A形成的10电子分子中,极性最强的共价键是______ (用化学键表示)。A、B、C
 三元素形成的最简单分子中
三元素形成的最简单分子中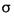 键与
键与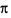 键个数比为______;
键个数比为______;②C、D分别与A形成的18电子分子X、Y可用作火箭推进剂。已知16g液态X与足量液态Y充分反应生成一种液态化合物和一种气态单质,并放出838kJ的热量,试写出X与Y反应的热化学方程式________________________。