摘要: 加热.依次发生的分解反应为,在2L密闭容器中充入8molN205.加热到t0C,达到平衡状态后O2为9mol.N2O3为3.4mol.则t0C 时反应①的平衡常数为 A. 10.7 B. 8.5 C. 9.6 D. 10.2
网址:http://m.1010jiajiao.com/timu3_id_431818[举报]
加热N2O5,依次发生的分解反应为①N2O5 N2O3+O2,②N2O3
N2O3+O2,②N2O3 N2O+O2;在1 L密闭容器中充入4 mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L。则t℃时N2O的平衡浓度为
N2O+O2;在1 L密闭容器中充入4 mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L。则t℃时N2O的平衡浓度为
| A.0.1 mol/L | B.1.4 mol/L | C.2.38 mol/L | D.2.88 mol/L |
加热N2O5,依次发生的分解反应为①N2O5 N2O3+O2,②N2O3
N2O3+O2,②N2O3 N2O+O2;在1 L密闭容器中充入4 mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L。则t℃时N2O的平衡浓度为
N2O+O2;在1 L密闭容器中充入4 mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L。则t℃时N2O的平衡浓度为
 N2O3+O2,②N2O3
N2O3+O2,②N2O3 N2O+O2;在1 L密闭容器中充入4 mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L。则t℃时N2O的平衡浓度为
N2O+O2;在1 L密闭容器中充入4 mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L。则t℃时N2O的平衡浓度为| A.0.1 mol/L | B.1.4 mol/L | C.2.38 mol/L | D.2.88 mol/L |
加热N2O5,依次发生的分解反应为①N2O5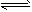 N2O3+O2,②N2O3
N2O3+O2,②N2O3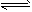 N2O+O2;在2 L密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9 mol,N2O3为3.4mol。则t℃时反应①的平衡常数为
N2O+O2;在2 L密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9 mol,N2O3为3.4mol。则t℃时反应①的平衡常数为
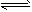 N2O3+O2,②N2O3
N2O3+O2,②N2O3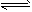 N2O+O2;在2 L密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9 mol,N2O3为3.4mol。则t℃时反应①的平衡常数为
N2O+O2;在2 L密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9 mol,N2O3为3.4mol。则t℃时反应①的平衡常数为 [ ]
A. 10.7
B. 8.5
C. 9.6
D. 10.2
查看习题详情和答案>>
B. 8.5
C. 9.6
D. 10.2
加热N2O5,依次发生的分解反应为①N2O5N2O3+O2,
②N2O3N2O+O2;在2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol。则t℃时反应①的平衡常数为 ( )
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看习题详情和答案>>
硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。请用给出的仪器、药品(如图6-13所示)设计一个实验,测定硫酸铜在加热分解时产生的氧气、二氧化硫、三氧化硫与参加反应的硫酸铜的物质的量的关系,并确定在该条件下硫酸铜分解反应的化学方程式。?

图6-13
实验测得数据和有关结果如下:①准确称量4.80 g无水硫酸铜;②测出量筒中水的体积(折算成标准状况下气体的体积)为224 mL;③干燥管在实验后质量增加2.56 g;④实验结束时装置F中的溶液变为Na2SO4溶液(不含其他杂质)。请完成下列各题:?
(1)硫酸铜加热分解产生的混合气体首先通过 (填序号),发生反应的化学方程式为 。?
(2)若气流方向从左向右,分解后混合气体依次通过装置的顺序为 (填进出口序号)。
(3)装置D的作用是 ;装置C的作用是 。
(4)根据测得的数据,确定该条件下硫酸铜分解反应的化学方程式: 。
查看习题详情和答案>>