题目内容
硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。请用给出的仪器、药品(如图6-13所示)设计一个实验,测定硫酸铜在加热分解时产生的氧气、二氧化硫、三氧化硫与参加反应的硫酸铜的物质的量的关系,并确定在该条件下硫酸铜分解反应的化学方程式。?
图6-13
实验测得数据和有关结果如下:①准确称量4.80 g无水硫酸铜;②测出量筒中水的体积(折算成标准状况下气体的体积)为224 mL;③干燥管在实验后质量增加2.56 g;④实验结束时装置F中的溶液变为Na2SO4溶液(不含其他杂质)。请完成下列各题:?
(1)硫酸铜加热分解产生的混合气体首先通过 (填序号),发生反应的化学方程式为 。?
(2)若气流方向从左向右,分解后混合气体依次通过装置的顺序为 (填进出口序号)。
(3)装置D的作用是 ;装置C的作用是 。
(4)根据测得的数据,确定该条件下硫酸铜分解反应的化学方程式: 。
(1)F SO3+2NaHSO4![]() Na2SO4+2SO2+H2O?
Na2SO4+2SO2+H2O?
(2)1—10—9—6—5—3—4—8—7—2?
(3)干燥SO2和O2 保证后面碱石灰吸收的是SO2?
(4)3CuSO4![]() 3CuO+2SO2↑+SO3↑+O2↑?
3CuO+2SO2↑+SO3↑+O2↑?
解析:由于CuSO4加热分解产生3种气体,为了确定分解反应方程式,必须知道3种气体各自的物质的量。由于SO3、SO2是极易或易溶于水的气体,故最终采用气体排水量气的只能是O2。干燥管实验质量增加是吸收的SO2(水已被浓H2SO4吸收),但需注意SO3与NaHSO3溶液反应时又产生了SO2。?
n(CuSO4)=![]() =0.03 mol?
=0.03 mol?
n(总SO2)=![]() =0.04 mol?
=0.04 mol?
(0.04-0.03) mol=0.01 mol?
SO3+2NaHSO3![]() Na2SO4+2SO2+H2O Δn(g)?
Na2SO4+2SO2+H2O Δn(g)?
1 mol 2 mol 1 mol?
0.1 mol 0.02 mol 0.01 mol?
n(原SO2)=n(总SO2)-n(生SO2)=0.04 mol-0.02 mol=0.02 mol?
n(O2)=![]() =0.01 mol?
=0.01 mol?
故n(SO3)∶n(SO2)∶n(O2)∶n(CuSO4)=0.01∶0.02∶0.01∶0.03=1∶2∶1∶3

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案(15分)无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。某学生试图用下图所示装置来确定该化学反应中各物质的计量关系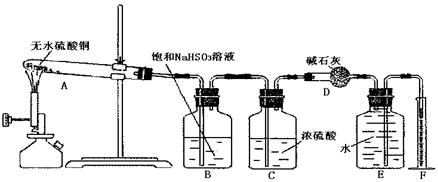
试回答:
(1)加热过程中,试管A中发生的实验现象为 。
(2)装置E和F的作用是 ;
(3)该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确
吗?为什么?
(4)该学生利用上述装置将一定质量的无水硫酸铜置于A中加热使其分解,最后测得氧
气的体积偏小,其原因可能是 (填序号)
| A.无水硫酸铜未完全分解o*m |
| B.实验结束时装置A中残留有气体 |
C.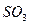 被 被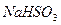 溶液吸收时产生了 溶液吸收时产生了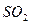 气体 气体 |
| D.最后读量筒中的读数时,E中的液面低于F中的液面 |
 出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为 mol,三氧化硫为 mol。
出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为 mol,三氧化硫为 mol。(6)由上述实验数据可知无水硫酸铜受热分解的化学方程式为:
___________________________________________________________________

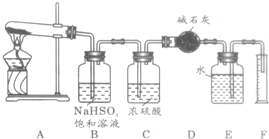 硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.实验测得数据和有关结果如下:
硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.实验测得数据和有关结果如下:
 被
被 溶液吸收时产生了
溶液吸收时产生了 气体
气体