网址:http://m.1010jiajiao.com/timu3_id_431784[举报]

(1)1 mol水中有______________ mol“氢键”。
(2)水分子电离生成两种含有相同电子数的微粒,其电离方程式为______________________。
(3)在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接,在冰中除氢键外,还存在分子间作用力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰中氢键的能量是______________ kJ·mol-1。
(4)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是______________,其判断依据是____________________________________________________________。
查看习题详情和答案>>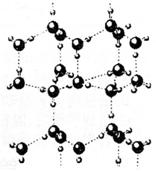
(1)1 mol冰中有___________ mol“氢键”。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为_________________。
(3)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃)则x、y、z的大小关系是__________。
(4)实验测得冰中氢键的作用能为18.8 kJ·mol-1,而冰的熔化热为5.0 kJ·mol-1,这说明______________________________。
查看习题详情和答案>>水分子间存在一种叫“氢键”的作用(介于范德华力与化学键之间),且其彼此结合而形成(H2O)n.在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体——冰,其结构示意图如下所示:
(1)1 mol冰中有________mol氢键.
(2)水分子中可电离生成两种含有相同电子数的微粒,其电离方程式为________.
(3)在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接.在冰中除氢键外,还存在分子间的作用力(11 kJ·mol-1).已知冰的升华热是51 kJ·mol-1,则冰中氢键的能量是________kJ·mol-1.
(4)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是________,其判断依据是________.
(10分)下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.150 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 | +3 | +2 |
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与W组成含18电子的化合物甲,甲的电子式为 ;R与X形成化合物乙R2X,用电子式表示乙的形成过程_____________________________
(3)写出Q与R最高价氧化物对应水化物反应的离子方程式_____________________。
(4)Y的氧化物是主要大气污染物之一,写出一种与之有关的污染现象______________。 查看习题详情和答案>>
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.150 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 | +3 | +2 |
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与W组成含18电子的化合物甲,甲的电子式为 ;R与X形成化合物乙R2X,用电子式表示乙的形成过程_____________________________
(3)写出Q与R最高价氧化物对应水化物反应的离子方程式_____________________。
(4)Y的氧化物是主要大气污染物之一,写出一种与之有关的污染现象______________。