网址:http://m.1010jiajiao.com/timu3_id_431781[举报]
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等。回答以下问题:
(1)N的基态原子中,有 个运动状态不同的未成对电子。
(2)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是_______。
(3)NH3、N2H4、NH4+、N2H62+四种微粒中,同种微粒间能形成氢键的有____________;不能作为配位体的有____________。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因 是 。
(5)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子的杂化类型是______。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(6)肼能与硫酸反应生成N2H6SO4。N2H6SO4化合物类型与硫酸铵相同,则N2H6SO4 内微粒间作用力不存在_______(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
查看习题详情和答案>>
(1)写出B在周期表中的位置_______;画出G离子的结构示意图________。
(2)由C、D形成的一种淡黄色固体的电子式__________________。
(3)写出E的最高价氧化物的水化物溶解于D的最高价氧化物的水化物的离子方程式:_________________________。
(4)F和C形成的晶体微粒间的相互作用力是____________。
(5)化合物甲的治理方法之一是用软锰矿浆(主要成分为MnO2)吸收法,该方法能做到“综合治理、变废为宝”,请写出其反应的化学方程式_____________________ 。
(6)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀经过滤、洗涤、干燥后,称得质量为4.66g
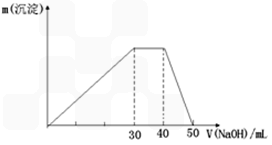
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,得到的沉淀和滴加的氢氧化钠溶液体积的关系如下图:则该正盐的化学式为________________ ;该物质可以用作为净水剂,其原理为____________________。(用离子方程式表示)
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T在周期表中的位置是处于 周期 族。
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(3)元素Y与氢元素形成一种分子YH3,写出该微粒的电子式 。
(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是__ ___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是
(用化学式表示)。
查看习题详情和答案>>(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
(2)当n=2时,B与C形成的晶体属于
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
氮元素可以形成多种分子和离子,如NH3、N2H4、N3-、NH4+、N2H62+等.
回答以下问题:
(1)某元素原子与N3-含有相同的电子数,其基态原子的价电子排布式是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被一NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
(4)胼能与硫酸反应生成N2H6S04.N2H6S04晶体类型与硫酸铵相同,则N2H6S04的晶体内不存在
a.离子键 b.共价键 c.配位键 d.范德华力
(5)NH3、N2H4、NH4+、N2H62+四种微粒中,能形成氢键的有