摘要:29.(B)海水是巨大的资源宝库.从海水中提取食盐和溴的过程如下: (1)请列举海水淡化的一种方法: . (2)将NaCl溶液电解.在电解槽中可直接得到的产品H2. . .或H2. . (3)步骤Ⅰ中已获得Br2.步骤Ⅱ中又将Br2还原为Br-.其目的为 . (4)步骤Ⅱ用SO2水溶液吸收Br2.吸收率可达95%.有关反应的离子方程式为 .由此反应可知.除环境保护外.在工业生产中应解决的主要问题是 . (5)某化学研究性学习小组为了解从工业溴中提纯溴的方法.查阅了有关资料.Br2的沸点为59℃.微溶于水.有毒性和强腐蚀性.他们参观生产过程后.了解到如下装置: 请你参与分析讨论: ① 图中仪器B的名称: . ② 整套实验装置中仪器连接均不能用橡胶塞和橡胶管.其原因是 . ③ 实验装置气密性良好.要达到提纯溴的目的.操作中如何控制关键条件: . ④ C中液体产生颜色为 .为除去该产物中仍残留的少量Cl2.可向其中加入NaBr溶液.充分反应后.再进行的分离操作是 .
网址:http://m.1010jiajiao.com/timu3_id_431671[举报]
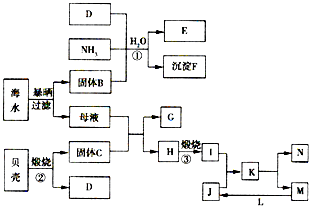 [化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
[化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).(1)反应①是著名的侯氏制碱法生产原理中的重要反应,其化学反应方程式是
NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
.实际生产中,在固体B的溶液中是先通入D气体还是先通入NH3?
先通入NH3
先通入NH3
.(2)对固体B精制后,用惰性电极电解其水溶液,阴极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
.(3)在上述转化关系中,电解熔融态的K可制得一种常见的金属N.写出该反应的化学方程式
MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||
(4)由K溶液经如何处理才能制得N?
MgCl2溶液要在HCl气体氛围中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁
MgCl2溶液要在HCl气体氛围中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁
.海水是巨大的资源宝库.如图是人类从海水资源获取某些重要化工原料的流程示意图.

回答下列问题:
(1)操作A是
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是
(4)图中虚线框内流程的主要作用是
(5)将MgCl2转化为Mg时获得的副产品是
查看习题详情和答案>>

回答下列问题:
(1)操作A是
蒸发结晶
蒸发结晶
(填实验基本操作名称).用何种方法知道海水晒盐的过程中溶液里食盐含量在逐渐提高?b
b
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是
c
c
(选填编号).a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
,操作C是热空气吹出
热空气吹出
.(4)图中虚线框内流程的主要作用是
富集Br2
富集Br2
;与之目的相同的流程在图中还有几处,试指出其中一处海水蒸发结晶得到粗盐或苦卤→Mg(OH)2→MgCl2溶液
海水蒸发结晶得到粗盐或苦卤→Mg(OH)2→MgCl2溶液
.(5)将MgCl2转化为Mg时获得的副产品是
Cl2
Cl2
,用化学方程式表示该物质的某种用途2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.海水是巨大的资源宝库,下列说法正确的是( )
| A、碘元素又称“海洋元素” | B、镁是海水中含量最多的金属元素 | C、从海水中提取食盐和碘的过程都是物理变化 | D、氯碱工业和纯碱工业的原料都有食盐 |
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
| A、海水蒸发制海盐的过程只发生了化学变化 | B、海水中含有钾元素,只需要经过物理变化就可以得到钾单质 | C、利用潮汐发电是将化学能转化为电能 | D、从海水中提取溴单质的过程涉及氧化还原反应 |
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
| A、海水中含有钾元素,只需经过物理变化就可以得到钾单质 | B、海水蒸发制得粗盐,经提纯后再电解可以得到Cl2 | C、海水制备镁单质的过程中涉及的反应类型有:分解反应、复分解反应和置换反应 | D、可以直接从海水中提取溴单质和碘单质 |