网址:http://m.1010jiajiao.com/timu3_id_430748[举报]
某化学小组利用下图装置完成Fe2O3 和CO的反应.

(1)实验开始前,首先必须进行的操作为______.实验开始时,通入CO气体和加热的先后顺序为______,点燃酒精灯之前,必须检验从装置中排出的CO的纯度.实验过程中,判断反应发生的现象为______.
(2)实验时可在酒精灯火焰上罩一个金属网罩,该金属网罩的作用是______、______.若要提高反应温度,还可选用的加热仪器为______.
(3)查阅资料知,Fe2O3和CO进行加热反应,固体质量与反应温度的关系如下图所示.
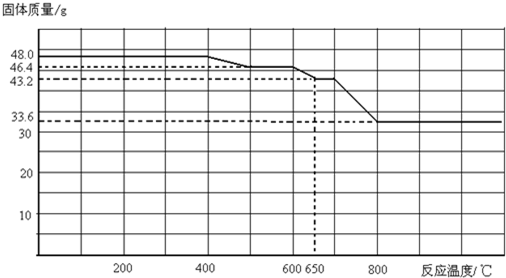
现测得酒精灯对Fe2O3加热温度可达到500℃~600℃,则该温度下,Fe2O3 的还原产物是______.请设计一个简单的实验,证明650℃~700℃时Fe2O3的还原产物,简述实验操作和现象______.可供选择的试剂:稀H2SO4、稀盐酸、KMnO4溶液、NaOH溶液、KSCN溶液.
查看习题详情和答案>>

(1)实验开始前,首先必须进行的操作为______.实验开始时,通入CO气体和加热的先后顺序为______,点燃酒精灯之前,必须检验从装置中排出的CO的纯度.实验过程中,判断反应发生的现象为______.
(2)实验时可在酒精灯火焰上罩一个金属网罩,该金属网罩的作用是______、______.若要提高反应温度,还可选用的加热仪器为______.
(3)查阅资料知,Fe2O3和CO进行加热反应,固体质量与反应温度的关系如下图所示.

现测得酒精灯对Fe2O3加热温度可达到500℃~600℃,则该温度下,Fe2O3 的还原产物是______.请设计一个简单的实验,证明650℃~700℃时Fe2O3的还原产物,简述实验操作和现象______.可供选择的试剂:稀H2SO4、稀盐酸、KMnO4溶液、NaOH溶液、KSCN溶液.
查看习题详情和答案>>
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3H++HCO3- Ka1 =4.45×10-7
HCO3-H++CO32- Ka2=5.61×10-11
HClOH++ClO- Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
查看习题详情和答案>>
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。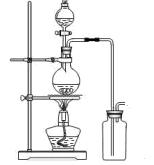
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3 H++HCO3- Ka1 =4.45×10-7
H++HCO3- Ka1 =4.45×10-7
HCO3- H++CO32- Ka2=5.61×10-11
H++CO32- Ka2=5.61×10-11
HClO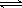 H++ClO- Ka=2.95×10-8
H++ClO- Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
(14分)某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
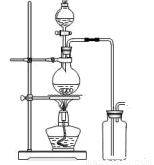
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有 试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因 。
(3)已知:H2CO3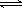 H++HCO3-
Ka1 =4.45×10-7
H++HCO3-
Ka1 =4.45×10-7
HCO3-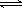 H++CO32-
Ka2=5.61×10-11
H++CO32-
Ka2=5.61×10-11
HClO H++ClO-
Ka=2.95×10-8
H++ClO-
Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在 位置后(填字母)增加一个装置,该装置中应加入 试剂,其作用 。
查看习题详情和答案>>