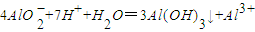摘要:(D )1. 下列离子方程式正确的是 A.氯化铝溶液加入氨水:Al3+ + 3OH-Al(OH)3 ↓ B.实验室用氯化铵和熟石灰制氨气:NH4++OH-==NH3↑+H2O C.碳酸氢钙溶液加入盐酸:CO32-+2H+==H2O+CO2↑ D.硫酸铵溶液跟氢氧化钡溶液混合:2NH4++SO42-+Ba2++2OH-==BaSO4↓+2NH3·H2O (C )2. 下列气体.不能用排空气法收集的是 A.CO2 B.NO2 C.NO D.H2 ( B )3. 仅用水.不可能除净除尽杂质气体的是 A.氢气中的氨气 B.氧气中的二氧化碳 C.空气中的氯化氢 D.一氧化氮中的二氧化氮 2溶液与pH=12的KOH溶液.按4:1的体积比混合.则溶液中c(H+)为 A. (4×10-9 + 1×10-12) 1/5 B. (8×10-9 + 1×10-12) 1/5 C. 5×10-10 D. 5×10-12 ( D )5.将pH=8的Ba(OH)2溶液加水稀释1000倍.稀释后所得溶液中Ba2+浓度与OH-浓度之比为 A. 1:2 B. 1:200 C.1:50 D. 1:100 ( A )6.用水稀释0.1mol/L的醋酸溶液.其中随水的增加而最终增大的有 ①H+的物质的量 ②c(H+) ③c(OH-) ④c(H+)/c/c(Ac-) A. ①③④ B. ①③⑤ C. ②④ D. ③④ ( B )7.某强酸溶液pH=a , 强碱溶液pH=b, 已知a+b=16.在常温下混合后pH=7.则酸溶液体积V酸和碱溶液的体积V碱的准确关系是: A. V碱=102V酸 B. V酸=102V碱 C. V酸=2V碱 D. V碱=2V酸 ( B )8.在可逆反应mA pC(g)中.m.n.p为系数.且m+n>p.正反应是放热反应.分析下列各图.在平衡体系中A的质量分数与温度toC.压强P关系正确的是 -1- ( D )9.对于达平衡的可逆反应X+YW+Z.增大压强则正.逆反应速率(v)的变化如图.分析可知X.Y.Z.W的聚集状态可能是 A. Z.W为气体.X.Y中之一为气体 B. Z.W中之一为气体.X.Y为非气体 C. X.Y.Z.W皆为气体 D. X.Y为气体.Z.W中之一为气体 ( C )10. PH=7的盐酸和PH=9的氢氧化纳溶液以体积比11:9混合.混合液的pH A. 为7.2 B. 为8 C. 为6 D. 无法计算 ( B )11. 取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后.再分别加入0.03g锌粉.在相同条件下充分反应.有关叙述正确的是 A. 醋酸与锌反应放出氢气多 B. 盐酸和醋酸分别与锌反应放出的氢气一样多 C. 醋酸与锌反应速率小 D. 盐酸和醋分别与锌反应的速度一样大 ( D )12. 从下列现象可以判断某酸是强酸的是 A.加热该酸至沸腾也不分解 B.该酸可以分解石灰石放出CO2 C.该酸可以把Al(OH)3沉淀溶解 D.该酸浓度为0.1mol·L-1时的pH为1 ( A )13. 将0.1mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时.都会引起 A. 溶液的pH增加 B. CH3COOH电离度变大 C. 溶液的导电能力减弱 D. 溶液中c(OH-)减少 ( D )14. 用0.01mol/L NaOH溶液完全中和pH=3的下列溶液各100mL.需NaOH溶液体积最大的是 A. 盐酸 B. 硫酸 C. 高氯酸 D. 醋酸 ( A)15. 用pH均为2的盐酸和醋酸溶液.分别中和等体积.等物质的量浓度的氢氧化钠溶液.当氢氧化钠恰好被完全中和时.消耗盐酸和醋酸溶液的体积分别为Vl和V2.则Vl和V2的关系正确的是 A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤V2
网址:http://m.1010jiajiao.com/timu3_id_43057[举报]
下列离子方程式正确的是( )
A.NaHSO3溶液中投入过氧化钠粉末:4HSO3- +2Na2O2 == 4SO32- + O2↑ + 4Na+
B.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
查看习题详情和答案>>下列离子方程式正确的是( )
A.NaHSO3溶液中投入过氧化钠粉末:4HSO3- +2Na2O2 = 4SO32- + O2↑ + 4Na+
B.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O==AlO2-+4NH4++2H2O
C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
查看习题详情和答案>>