摘要:右边是短周期的一部分.若a原子的最外层上有5个电子.则下列说法中错误的是-( ) d a b c A.c单质可跟b的氢化物的水溶液反应 B.原子半径a>b>c﹥d C.b的氢化物比C的氢化物不稳定 D.a的最高价氧化物的水化物比b的最高价氧化物的水化物酸性强
网址:http://m.1010jiajiao.com/timu3_id_430444[举报]
现有部分短周期元素的性质或原子结构如下表:
完成下列问题:
(1)元素T在周期表中位于第
(2)T、X、Y、Z、M原子半径由大到小的顺序是
(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是
 .
.
(4)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是
(6)右图为元素X与Z形成的化合物分子XZ2的晶胞结构,在该晶胞中,离每一个XZ2最近的XZ2有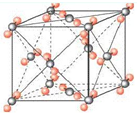
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 原子最外层电子数是次外层的三倍 |
| M | 与X、Y、Z既能形成10电子分子又能形成18电子分子 |
(1)元素T在周期表中位于第
3
3
周期第16
16
纵行.(2)T、X、Y、Z、M原子半径由大到小的顺序是
S>C>N>O>H
S>C>N>O>H
.(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是


(4)元素Z与元素T相比,非金属性较强的是
O
O
(用元素符号表示),下列表述中能证明这bd
bd
.a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
,已知该盐溶液的pH值为5,则该盐溶液中水电离出的氢离子浓度为10-5mol/L
10-5mol/L
.(6)右图为元素X与Z形成的化合物分子XZ2的晶胞结构,在该晶胞中,离每一个XZ2最近的XZ2有
12
12
个,若
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为
4M/(a3NA)
4M/(a3NA)
g/cm3.(写出表达式)下表中的实线表示元素周期表部分边界。途中的字母分别表示元素周期表中对应位置的元素。

(1)请在上面的元素周期表中用实线画出周期表未完成的边界。
(2)表中字母对应的元素中,非金属性最强的元素的名称是 ,请用一个化学方程式表示出该元素的非金属性比e对应元素强 。
(3)第三周期的8种元素按单质熔点大小
顺序的柱形图如右所示,
其中序列“8”所对应元素的元素符号是 。
(4)现有b、d、h三种元素的氢化物,其中沸点最高的氢化物的空间构型是 。
(5)i对应的元素的最高价氧化物对应水化物的电离方程式为 。
Ⅱ、(5分)现有下列短周期元素的性质数据:
编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(10-10) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
试回答下列问题:
(1)上述元素中处于第ⅤA族的有 ,处于第二周期的有
(以上均用编号回答)
(2)上述元素中金属性最强的是 (用编号回答)
(3)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)
即(n-m)≥0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于或等于
原子的电子层数(n)即(n-m)<0时,该元素属于非金属元素。试回答:
a、第n(n≥2)周期有 种非金属元素(含零族元素)
b、根据周期表中每个周期非金属元素的种数(含零族元素),预测目前的周期表若填满后还有 种非金属元素未被发现。
查看习题详情和答案>>
现有部分短周期元素的性质或原子结构如下表:
完成下列问题:
(1)元素T在周期表中位于第______周期第______纵行.
(2)T、X、Y、Z、M原子半径由大到小的顺序是______.
(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是______.
(4)元素Z与元素T相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这______.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是______,已知该盐溶液的pH值为5,则该盐溶液中水电离出的氢离子浓度为______.
(6)右图为元素X与Z形成的化合物分子XZ2的晶胞结构,在该晶胞中,离每一个XZ2最近的XZ2有______个,若
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为______g/cm3.(写出表达式)
 查看习题详情和答案>>
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 原子最外层电子数是次外层的三倍 |
| M | 与X、Y、Z既能形成10电子分子又能形成18电子分子 |
(1)元素T在周期表中位于第______周期第______纵行.
(2)T、X、Y、Z、M原子半径由大到小的顺序是______.
(3)元素Z与M可形成4原子18电子的分子,该分子的电子式是______.
(4)元素Z与元素T相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这______.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c. Z的氢化物沸点比T的氢化物沸点高
d.Z单质可将T单质从其氢化物水溶液中置换出来
(5)Y、Z、M可以形成一种盐,此盐中M、Y、Z元素的原子的个数比为4:2:3,该盐的水溶液中离子浓度由大到小的顺序是______,已知该盐溶液的pH值为5,则该盐溶液中水电离出的氢离子浓度为______.
(6)右图为元素X与Z形成的化合物分子XZ2的晶胞结构,在该晶胞中,离每一个XZ2最近的XZ2有______个,若
已知该晶胞的边长为a cm,XZ2的摩尔质量为M g/mol,阿伏伽德罗常数为NA.则该晶胞的密度为______g/cm3.(写出表达式)
 查看习题详情和答案>>
查看习题详情和答案>>