网址:http://m.1010jiajiao.com/timu3_id_430315[举报]
⑴事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是____________________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
⑵以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为_______________。
⑶电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则: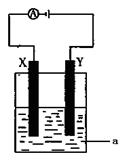
①若a为CuSO4溶液,则电解时的化学反应方程式为____________________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
⑴事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是____________________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
⑵以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为_______________。
⑶电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:

①若a为CuSO4溶液,则电解时的化学反应方程式为____________________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
查看习题详情和答案>>
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
⑵以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为_______________。
⑶电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
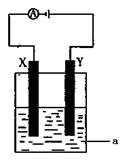
①若a为CuSO4溶液,则电解时的化学反应方程式为____________________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
|
事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 | |
| [ ] | |
A. |
C(s)+H2O(g)=CO(g)+H2(g) ΔH>0 |
B. |
2H2(g)+O2(g)=2H2O(l) ΔH<0 |
C. |
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0 |
