网址:http://m.1010jiajiao.com/timu3_id_429879[举报]
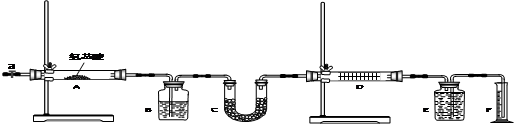
(1)写出装置D中分别盛放的试剂:D
(2)检查装置气密性,进行如下操作后A中氨基酸开始反应,请用序号表示正确的操作顺序
(3)样品氨基酸充分燃烧后,待E装置气体冷却至室温后记录F装置的液面读数,请指出读数时应注意的问题:
(4)通过该实验所能测定的数据,能否确定该氨基酸的分子式:
II.室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀.为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究.
(1)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三:
(2)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;KSP〔CuCO3〕=1.4×10-10
KSP〔Cu(OH)2〕=5.6×10-20若只由此数据结合适当计算来判断,最有可能正确的是假设
(3)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成.
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤,②
步骤三:利用下图所示装置,进行定量分析:
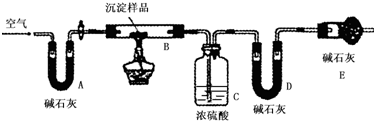
①A装置中玻璃仪器的名称是U 形管.
②仪器组装好后首先要进行的实验操作是
③实验结束时通入过量的空气的作用是保证装置中的水蒸气和CO2被C、D装置完全吸收.
④数据记录:
(4)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为
| B装置的质量(g) | C装置的质量(g) | D装置的质量(g) | |
| 实验前 | 15.4 | 262.1 | 223.8 |
| 试验后 | 6.1 | 264.8 | 230.4 |
(1)下列化学反应符合绿色化学概念的是________。
A.制取有机玻璃的单体:
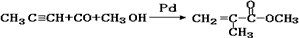
B.制取CuSO4:
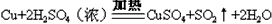
C.制取乙苯:
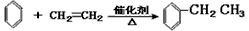 (催化剂是氯化铝,氯化铝和加入的盐酸都有较强的腐蚀性,生产过程中产生大量废液、废气)
(催化剂是氯化铝,氯化铝和加入的盐酸都有较强的腐蚀性,生产过程中产生大量废液、废气) D.制取Cu(NO3)2:2Cu+O2
 2CuO CuO+2HNO3(稀)=Cu(NO3)2+H2O
2CuO CuO+2HNO3(稀)=Cu(NO3)2+H2O (2)化学电池在通讯、交通及日常生活中有着广泛的应用。但废旧电池的妥善处理已成为我们日常生活十分头痛的问题,资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。常用的镍镉电池的总反应可以表示为:Cd+2NiO(OH)+2H2O
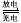 2Ni(OH)2+Cd(OH)2 已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。在酸性土壤中这种污染尤为严重。这是因为_______________________。
2Ni(OH)2+Cd(OH)2 已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。在酸性土壤中这种污染尤为严重。这是因为_______________________。 (3)硫酸工业的尾气中主要含有气体,下列有关它的叙述错误的是________。
A.形成硫酸型酸雨
B. 破坏臭氧层
C. 不会腐蚀建筑物
D.能跟血红蛋白结合使人体中毒
E.能使品红、酸性KMnO4褪色,并且褪色原理相同
该尾气我们可采用过量氨水吸收,请写出化学反应方程式________________。请判断这种处理方法是否符合绿色化学的概念___(填“是”或“否”)并说明理由__________________。
(14分)近年来,随着我国经济的快速发展,对电力的需求越来越高,这也促进了我国电力工业高速发展,但我国电力结构中,火电比重非常大,占发电装机总容量的75%以上,且火电比重还在逐年上升。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为: 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)CH3OH(g)+H2O(g);ΔH3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 (填字母代号)。
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol·L-1
B.0~10min内,氢气的平均反应速率为0.075mol/(L·min)
C.达到平衡时,氢气的转化率为0.75
D.升高温度将使n(CH3OH)/n(CO2)减小
③甲醇碱性燃料电池工作时负极的电极反应式可表示为 。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为: 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为: ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。
查看习题详情和答案>>
(14分)近年来,随着我国经济的快速发展,对电力的需求越来越高,这也促进了我国电力工业高速发展,但我国电力结构中,火电比重非常大,占发电装机总容量的75%以上,且火电比重还在逐年上升。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为: 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为: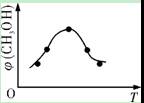
CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 (填字母代号)。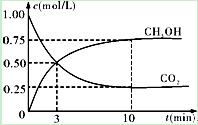
| A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol·L-1 |
| B.0~10min内,氢气的平均反应速率为0.075mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
| D.升高温度将使n(CH3OH)/n(CO2)减小 |
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为: 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为: ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。 查看习题详情和答案>>
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为: 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:

CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 (填字母代号)。
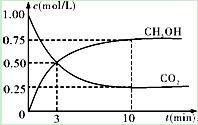
| A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol·L-1 |
| B.0~10min内,氢气的平均反应速率为0.075mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
| D.升高温度将使n(CH3OH)/n(CO2)减小 |
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为: 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为: ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。