网址:http://m.1010jiajiao.com/timu3_id_429578[举报]

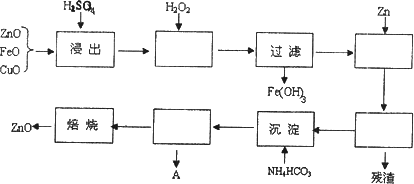
(1)上述流程中,浸出用的是密度为1.5g/cm3,质量分数为60%H2SO4,则该H2SO4的物质的量浓度为
(2)已知:常温下Fe(OH)3的Ksp=4.0×10-38.上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04mol/L,控制滤液的pH,加入H2O2后产生大量红褐色沉淀.
①滤液的pH至少为
②若控制滤液的pH过大,可能导致的后果是
(3)A中主要含有的溶质是
(4)已知:制备活性ZnO,所焙烧的物质是碱式碳酸锌(可能含结晶水).取碱式碳酸锌6.82g,溶于HCl生成CO2 448mL(标准状况下),溶解过程消耗HCl 0.12mol,试推测该碱式碳酸锌的化学式
活性ZnO在橡胶、塑料、涂料工业有重要应用,由粗ZnO(含FeO、CuO)制备活性ZnO流程如下:(已知:活性ZnO可用焙烧碱式碳酸锌制得)
(1)上述流程中,浸出用的是60%H2SO4(1.5 g/cm3),配制这种H2SO4 100 ml需要98%H2SO4________g(保留两位小数).
(2)加H2O2的目的是________;
(3)除去Fe(OH)3后,滤液中加入Zn,这一步操作的目的是________;
(4)整个流程一共有________次过滤;
(5)流程A中主要含有的溶质是________,检验该溶质阴离子的方法是________;
(6)取碱式碳酸锌6.82 g,溶于HCl生成CO2 448 ml,溶解过程消耗HCl 0.12 mol,若该碱式盐中氢元素的质量分数为0.0176,试推测该碱式碳酸锌的化学式________.
(10分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请问答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ▲ ,该步骤需控制溶液pH的范围是 ▲ 。
(2)A溶液中主要含有的溶质是 ▲ 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是:△S ▲ (选填“=”、“>”、“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
查看习题详情和答案>>
(10分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO): 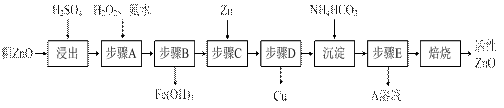
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
(1)步骤A加H2O2发生反应的离子方程式是 ▲ ,该步骤需控制溶液pH的范围是 ▲ 。
(2)A溶液中主要含有的溶质是 ▲ 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是:△S ▲ (选填“=”、“>”、“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓
 度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
查看习题详情和答案>>
度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
查看习题详情和答案>>
(15分)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):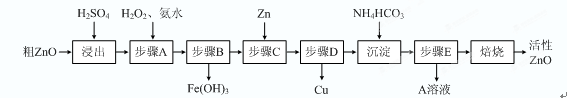
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
⑴步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
⑵ A溶液中主要含有的溶质是 。
⑶碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是 。
⑷若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。 查看习题详情和答案>>