摘要:23.[化学-选修化学与技术] 空气吹出法工艺.是目前“海水提溴 的最主要方法之一.其工艺流程如下:源网] (1)溴在周期表中位于 周期 族. (2)步骤①中用硫酸酸化可提高Cl2的利用率.理由是 . (3)步骤④利用了SO2的还原性.反应的离子方程式为 . (4)步骤⑥的蒸馏过程中.温度应控制在80-90℃.温度过高或过低都不利于生产 .请解释原因 . (5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物.可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是 . (6)步骤①.②之后并未直接用“含Br2的海水 进行蒸馏得到液溴.而是经过“空气吹出 .“SO2吸收 .“氯化 后再蒸馏.这样操作的意义是 .
网址:http://m.1010jiajiao.com/timu3_id_429434[举报]
[化学选修——2:化学与技术](15分)
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
[化学选修——2:化学与技术](15分)
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
(3)海水提镁的一段工艺流程如下图:
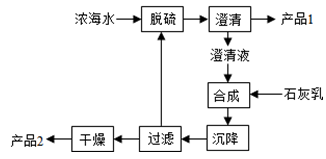
浓海水的主要成分如下:

该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O
 NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:

该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
(化学--选修化学与技术)
海水中溶解了大量的气体物质和各种盐类.人类在陆地上发现的100多种元素,在海水中可以找到80多种.海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景.回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大.为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议
(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
(3)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
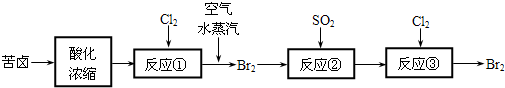
①反应②的离子方程式为
(4)苦卤中含有NaCl、MgCl2、KCl、MgSO4.用简要的文字说明如何测定苦卤中MgCl2的含量
查看习题详情和答案>>
海水中溶解了大量的气体物质和各种盐类.人类在陆地上发现的100多种元素,在海水中可以找到80多种.海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景.回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大.为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议
充分利用潮汐能、风能、太阳能等海边富有的洁净能源
充分利用潮汐能、风能、太阳能等海边富有的洁净能源
.(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式
CH2=CHCOONa
CH2=CHCOONa
.(3)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):

①反应②的离子方程式为
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+Br2+2H2O=4H++2Br-+SO42-
; ②从反应③后的四氯化碳溶液中分离出单质溴的方法是蒸馏
蒸馏
.(4)苦卤中含有NaCl、MgCl2、KCl、MgSO4.用简要的文字说明如何测定苦卤中MgCl2的含量
先用足量BaCl2溶液沉淀硫酸根离子,求出硫酸根离子的总量,并求出MgSO4的量,然后用足量NaOH溶液沉淀Mg2+,求出总的Mg2+,减去MgSO4中的Mg2+得到MgCl2的量
先用足量BaCl2溶液沉淀硫酸根离子,求出硫酸根离子的总量,并求出MgSO4的量,然后用足量NaOH溶液沉淀Mg2+,求出总的Mg2+,减去MgSO4中的Mg2+得到MgCl2的量
.(三选一)[选修2:化学与技术]
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下
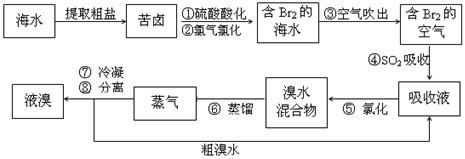
(1)溴在周期表中位于_______周期________ 族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是_________________。
(3)步骤④利用了SO2的还原性,反应的离子方程式为______________________。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产 ,请解释原因:________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_______________________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是___________________。
查看习题详情和答案>>
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是_________________。
(3)步骤④利用了SO2的还原性,反应的离子方程式为______________________。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产 ,请解释原因:________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_______________________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是___________________。
