网址:http://m.1010jiajiao.com/timu3_id_429162[举报]
(1)若在相同温度下,分别在
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5 mol 氩气,则N2的转化率会起什么变化?正反应速率与原平衡相比,有无变化,简答理由。
(3)若在
N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)若在相同温度下,分别在
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩尔氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在
①若x=0,y=0,则z=_____________。
②若x=0.75,则y应为_____________mol、z应为_____________mol。
③x、y、z应满足的一般条件是______________________________________。
查看习题详情和答案>> 2E(g),若开始时只充入2 molE,达到平衡时,混合气体的压强比起始时增大了20%;计算达到平衡时M的体积分数。
2E(g),若开始时只充入2 molE,达到平衡时,混合气体的压强比起始时增大了20%;计算达到平衡时M的体积分数。 | 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则
 a
a(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
醋酸的电离程度将如何变化
电离平衡常数将如何变化
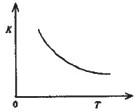
(4)合成氨发生的反应为N2+3H2 2NH3.400“C时,该反应平衡常数K=0.5mol-2.?L2.已知该反应的平衡常数与温度的关系如图所示.500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正