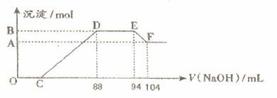
摘要:24.实验研究发现.硝酸发生氧化还原反应时.硝酸的浓度越稀.对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应.反应过程中无气体放出.在反应结束后的溶液中.逐滴加入5 mol·L-1的NaOH溶液.所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示.则 ⑴B与A的差值为 mol. ⑵C点对应的溶液体积为 mL. ⑶原硝酸溶液中含硝酸的物质的量为 mol. ⑷铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为 . ⑸写出铝与该浓度硝酸反应的离子方程式 . [答案]⑴0.05 ⑵40 ⑶0.5 ⑷5:3 ⑸8Al+30H++3NO3-=8Al3++3NH4++9H2O [解析]由题意知.金属与硝酸反应时.硝酸的还原产物为NH4NO3.由图又可看出金属与硝酸反应后.硝酸是过量的.故金属的氧化产物为Fe(NO3)3.Al(NO3)3.图中:①0→C:H++OH-=H2O,②C→88:R3++3OH-=R(OH)3↓,③88→94:NH4++ OH-=NH3•H2O,④94→104:Al(OH)3+ OH-=AlO2-+ 2H2O.由④知n[Al(OH)3]=0.01L×5mol·L-1=0.05 mol=n(Al).此值也是B与A的差值.由③知.n(NH4NO3)= 0.006L×5mol·L-1=0.03 mol.根据反应中得失电子相等的原则得:3n(R3+)=0.03×8=0.24 mol.则n(R3+)=0.08 mol=n.故混合物中n(Al):n(Fe)=5:3.0→88mL中.用于沉淀金属离子的OH-有0.08 mol×3=0.24 mol.故C点:(0.088L×5 mol·L-1-0.24 mol)/ 5 mol·L-1=0.04L.即40mL. [考点]化学计算与技巧.元素及其化合物
网址:http://m.1010jiajiao.com/timu3_id_428796[举报]
 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.问题:(1)铁粉与铝粉的混合物与该浓度硝酸反应后,溶液中的阳离子除了Al3+、Fe3+、另外还有
NH4+
NH4+
、H+
H+
(填离子符号)(2)B与A的差值为
0.008
0.008
mol(3)写出DE段离子反应方程式
NH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
(4)原混合物中铝粉与铁粉的物质的量之比为
1:3
1:3
.(5)原硝酸溶液中含硝酸的物质的量为
0.148
0.148
mol. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的镁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的镁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:(1)OC段没有沉淀生成,此阶段发生反应的离子方程式为:
H++OH-═H2O
H++OH-═H2O
.(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:
NH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
(3)B与A的差值为
0.008
0.008
mol,C点对应的氢氧化钠溶液的体积为7
7
mL.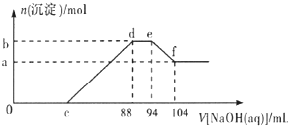 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的 化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL )与产生沉淀的物质的量( mol)关系如图所示,下列说法不正确的是( )
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的 化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL )与产生沉淀的物质的量( mol)关系如图所示,下列说法不正确的是( )| A、稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 | B、c点对应NaOH溶液的体积为48 mL | C、b点与a点的差值为0.05 mol | D、样品中铝粉和铁粉的物质的量之比为5:3 |