题目内容
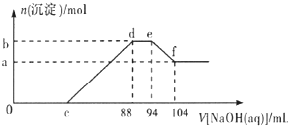 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的 化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL )与产生沉淀的物质的量( mol)关系如图所示,下列说法不正确的是( )
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的 化合价越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL )与产生沉淀的物质的量( mol)关系如图所示,下列说法不正确的是( )| A、稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵 | B、c点对应NaOH溶液的体积为48 mL | C、b点与a点的差值为0.05 mol | D、样品中铝粉和铁粉的物质的量之比为5:3 |
分析:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3?H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
b与a的差值为氢氧化铝的物质的量,计算ef段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;
根据de段消耗的氢氧化钠计算溶液中n(NH4+),结合Al(OH)3的物质的量,再根据电子转移守恒,计算Fe的物质的量;
由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,根据钠元素守恒计算硝酸钠,结合n(NH4+)可得n(NH4NO3),根据氮元素守恒可知:原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3),而c点溶液为NaNO3、NH4NO3、Fe(NO3)3、Al(NO3)3,根据氮元素守恒计算c点溶液中n′(NaNO3),进而计算NaOH溶液的体积,据此解答.
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3?H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
b与a的差值为氢氧化铝的物质的量,计算ef段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;
根据de段消耗的氢氧化钠计算溶液中n(NH4+),结合Al(OH)3的物质的量,再根据电子转移守恒,计算Fe的物质的量;
由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,根据钠元素守恒计算硝酸钠,结合n(NH4+)可得n(NH4NO3),根据氮元素守恒可知:原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3),而c点溶液为NaNO3、NH4NO3、Fe(NO3)3、Al(NO3)3,根据氮元素守恒计算c点溶液中n′(NaNO3),进而计算NaOH溶液的体积,据此解答.
解答:解:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3?H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
b与a的差值为氢氧化铝的物质的量,由图可知,ef段消耗的氢氧化钠溶液为104mL-94m=10mL,故该阶段参加反应的氢氧化钠为0.01L×5mol/L=0.05mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.05mol,根据铝元素守恒,故混合金属中n(Al)=0.05mol,
由图可知,de段消耗的氢氧化钠的体积为94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×5mol/L=0.03mol,根据NH4++OH-═NH3?H2O 可知,计算溶液中n(NH4+)=0.03ml,根据电子转移守恒有,3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,
由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,n(NH4NO3)=n(NH4+)=0.03mol,根据钠元素守恒,可知n(NaNO3)=n(NaOH)=0.088L×5mol/L=0.44mol,根据氮元素守恒计算原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,而c点溶液为NaNO3、NH4NO3、Fe(NO3)3、Al(NO3)3,根据氮元素守恒n′(NaNO3)+2n(NH4NO3)+3n[Fe(NO3)3]+3n[Al(NO3)3]=n(HNO3),故c点溶液中n′(NaNO3)=0.5mol-0.03mol×2-0.03mol×3-0.05mol×3=0.2mol,故c点加入NaOH的物质的量=0.2mol,
A.由上述分析可知,稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵,故A正确;
B.由上述分析可知,c点对应NaOH溶液的体积=
=0.04L=40mL,故B错误;
C.由上述分析可知,b与a的差值=n[Al(NO3)3]=0.05mol,故C正确;
D.由上述分析可知,混合金属中n(Al)=0.05mol、n(Fe)=0.03mol,样品中铝粉和铁粉的物质的量之比为5:3,故D正确,
故选B.
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3?H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
b与a的差值为氢氧化铝的物质的量,由图可知,ef段消耗的氢氧化钠溶液为104mL-94m=10mL,故该阶段参加反应的氢氧化钠为0.01L×5mol/L=0.05mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.05mol,根据铝元素守恒,故混合金属中n(Al)=0.05mol,
由图可知,de段消耗的氢氧化钠的体积为94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×5mol/L=0.03mol,根据NH4++OH-═NH3?H2O 可知,计算溶液中n(NH4+)=0.03ml,根据电子转移守恒有,3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,
由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,n(NH4NO3)=n(NH4+)=0.03mol,根据钠元素守恒,可知n(NaNO3)=n(NaOH)=0.088L×5mol/L=0.44mol,根据氮元素守恒计算原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,而c点溶液为NaNO3、NH4NO3、Fe(NO3)3、Al(NO3)3,根据氮元素守恒n′(NaNO3)+2n(NH4NO3)+3n[Fe(NO3)3]+3n[Al(NO3)3]=n(HNO3),故c点溶液中n′(NaNO3)=0.5mol-0.03mol×2-0.03mol×3-0.05mol×3=0.2mol,故c点加入NaOH的物质的量=0.2mol,
A.由上述分析可知,稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵,故A正确;
B.由上述分析可知,c点对应NaOH溶液的体积=
| 0.2mol |
| 5mol/L |
C.由上述分析可知,b与a的差值=n[Al(NO3)3]=0.05mol,故C正确;
D.由上述分析可知,混合金属中n(Al)=0.05mol、n(Fe)=0.03mol,样品中铝粉和铁粉的物质的量之比为5:3,故D正确,
故选B.
点评:本题以图象形式,考查金属与硝酸的反应、混合物计算等,清楚图中各阶段反应过程是解题的关键,解答中注意守恒思想的运用,为易错题目,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目