网址:http://m.1010jiajiao.com/timu3_id_428575[举报]
已知X和Y各是由两种常见元素组成的化合物,A.B为气体,G为白色沉淀,F是一种两性氢氧化物,在电解开始时,溶液中有白色 沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液C(有两种溶质),X.W.C.E的焰色反应均为黄色。各物质之间的关系如图所示(部分产物已经省略,除气体间的反应外,其余反应均在溶液中进行)。
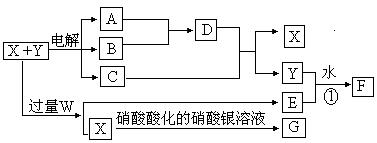
(1)X、Y、W的化学式分别为 . .
(2)写出反应①的离子方程式
(3)A与B反应生成1 mol D时放出热量为92.3 kJ,则此反应的热化学方程式为 。
(4)向澄清溶液C中加入10 mol·L-1的硫酸,当加至50 mL时才开始出现沉淀,假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100 mL,Y溶液的物质的量浓度为a mol·L-1,则X溶液的物质的量浓度为 mol·L-1(含a代数式表示)。
查看习题详情和答案>>已知X和Y各是由两种常见元素组成的化合物,A.B为气体,G为白色沉淀,F是一种两性氢氧化物,在电解开始时,溶液中有白色 沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液C(有两种溶质),X.W.C.E的焰色反应均为黄色。各物质之间的关系如图所示(部分产物已经省略,除气体间的反应外,其余反应均在溶液中进行)。
(1)X、Y、W的化学式分别为 . .
(2)写出反应①的离子方程式
(3)A与B反应生成1mol D时放出热量为92.3 kJ,则此反应的热化学方程式为 。
(4)向澄清溶液C中加入10 mol·L-1的硫酸,当加至50 mL时才开始出现沉淀,假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100 mL,Y溶液的物质的量浓度为a mol·L-1,则X溶液的物质的量浓度为 mol·L-1(含a代数式表示)。
查看习题详情和答案>>
已知X和Y各是由两种常见元素组成的化合物,A.B为气体,G为白色沉淀,F是一种两性氢氧化物,在电解开始时,溶液中有白色 沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液C(有两种溶质),X.W.C.E的焰色反应均为黄色。各物质之间的关系如图所示(部分产物已经省略,除气体间的反应外,其余反应均在溶液中进行)。

(1)X、Y、W的化学式分别为 . .
(2)写出反应①的离子方程式
(3)A与B反应生成1 mol D时放出热量为92.3 kJ,则此反应的热化学方程式为 。
(4)向澄清溶液C中加入10 mol·L-1的硫酸,当加至50 mL时才开始出现沉淀,假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100 mL,Y溶液的物质的量浓度为a mol·L-1,则X溶液的物质的量浓度为 mol·L-1(含a代数式表示)。
查看习题详情和答案>>
| |||||||||||||||||||||||
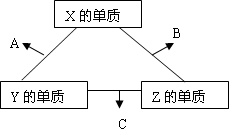
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体,F是由两种短周期元素构成的离子化合物,其转化关系如图 (反应条件和部分产物略去)。试回答:
(1) F的电子式是 。
(2)写出E与F反应生成B的化学方程式,并用双线桥标出电子转移的方向与数目
(3) 单质X和B或D均能反应生成黑色固体Y,Y与盐酸反应的离子方程式是 。若固体恰好溶解,则所得溶液呈 性。
(4) 物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(5) 取0.3 mol F与足量D充分混合后,所得溶液中再通入0.4 mol E充分反应,最后得到产物的物质的量比为 。(不考虑水解)
(6) E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热![]() ,氢气的燃烧热
,氢气的燃烧热![]() )
)