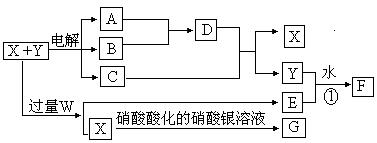
��Ŀ����
��֪X��Y���������ֳ���Ԫ����ɵĻ����A��BΪ���壬GΪ��ɫ������F��һ��������������ڵ�ʼʱ����Һ���а�ɫ ���������������ŵ��Ľ��У���ɫ�������ܽ⣬����Ϊ������ҺC�����������ʣ���X��W��C��E����ɫ��Ӧ��Ϊ��ɫ��������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ����Ѿ�ʡ�ԣ��������ķ�Ӧ�⣬���෴Ӧ������Һ�н��У���

��1��X��Y��W�Ļ�ѧʽ�ֱ�Ϊ �� ��
��2��д����Ӧ�ٵ����ӷ���ʽ
��3��A��B��Ӧ����1 mol Dʱ�ų�����Ϊ92.3 kJ����˷�Ӧ���Ȼ�ѧ����ʽΪ ��
��4���������ҺC�м���10 mol��L��1�����ᣬ������50 mLʱ�ſ�ʼ���ֳ������������������Һ����仯���Բ��ƣ�ԭX��Y���Һ�����Ϊ100 mL��Y��Һ�����ʵ���Ũ��Ϊa mol��L��1����X��Һ�����ʵ���Ũ��Ϊ mol��L��1����a����ʽ��ʾ����
��ÿ��2�֣���12�֣�
��1��NaCl��AlCl3��NaOH
��2��Al3+ + 3AlO2-+ 6H2O == 4Al(OH)3��
��3��H2(g) + C12(g)=2HCl(g) ��H= -184��6 kJ/mol
��4��a+10
���������ش��������⣺��֪X��NaCl��D��HCl����F��������������֪��ΪAl(OH)3��C��NaAlO2��NaOH �Ļ����Һ(�������4)��Y��AlCl3������X��Y��ˮ���ܷ�Ӧ����Al(OH)3����ɫ֪E��NaAlO2���ɴ�֪W��NaOH ��
�ɼ���50mL ����ų��ֳ���֪��C����1molNaOH��c(NaOH )=10mol/L������Ԫ���غ�֪c(NaAlO2)=c(AlCl3)=��mol/L���������غ�֪ ԭ��Һ��c(NaOH )=(10+a)mol/L��