网址:http://m.1010jiajiao.com/timu3_id_428538[举报]
下列化学实验相应的离子方程式正确的是
A.往Cu粉中加入稀硝酸:Cu+4H++2NO3— Cu2++2NO2↑+2H2O
B.NH4HCO3溶液与过量Ba(OH)2溶液共热:
NH4+ +HCO3— +2OH— ![]() CO32— +NH3↑+H2O
CO32— +NH3↑+H2O
C.往FeCl2溶液中加入过量溴水: 2Fe2+ +Br2 2Fe3++2Br—
D.往漂白粉溶液中通入过量二氧化碳:
Ca2+ +2ClO— +CO2+H2O CaCO3↓+2HClO
|
下列化学实验相应的离子方程式正确的是 | |
| [ ] | |
A. |
向Ba(OH)2溶液中滴加稀盐酸:2H++2C1-+Ba2++2OH-=2H2O+BaCl2 |
B. |
往FeCl3溶液中加入Fe粉:2Fe3++Fe |
C. |
往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2 |
D. |
往FeCl3溶液中加入Cu粉:Fe3++Cu |
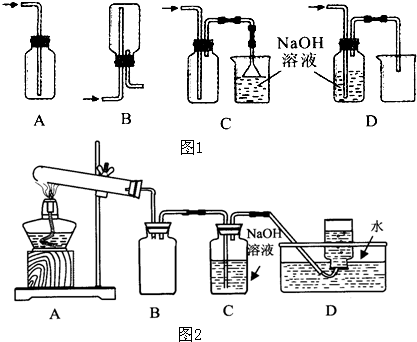
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验,如图1所示.
①写出该反应的离子方程式
②下列收集Cl2的装置正确装置是
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验.
用如图2所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
①装置B的作用是
②经小组讨论并验证该无色气体为O2,其验证方法是
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是:ⅠAg;ⅡAg2O;ⅢAg和Ag2O
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验.
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,④该小组得出的AgNO3固体热分解的化学方程式为
(12分)【化学——化学与技术】
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O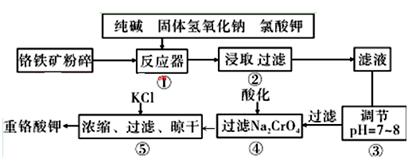
(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a =8 | B.x ="0.5" ,a =" 10" | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
某化学研究性学习小组为了探究四氯化锡的有关性质,拟先利用下列装置和药品进行四氯化锡的制备.已知四氯化锡具有强的吸水性,SnCl4和Sn的部分数据如下
| 密度 | 熔点 | 沸点 | |
| 四氯化锡 | 2.2g?cm-3 | -33℃ | 114℃ |
| 金属锡 | 5.77g?cm-3 | 231℃ |
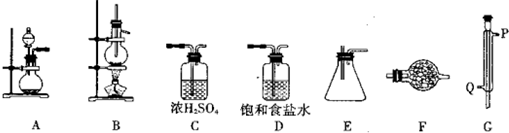
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→______→______→______→______→______→______;
(2)仪器G的名称是______;实验时,G中冷却水的流向是从______进入(填符号);
(3)A中发生反应的离子方程式为______;
(4)F中盛装的化学试剂是______;其作用是______;
(5)IVA族从上到下有C、Si、Ge、Sn、Pb等元素,请比较该族元素最高价氧化物对应水化物碱性的强弱顺序为(用化学式表示)______. 查看习题详情和答案>>