摘要:5.已知某饱和溶液的以下信息:①溶液质量,②溶剂质量,③溶液体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液密度.其中不能用来计算该饱和溶液的物质的量浓度的组合是 ( ) A.④⑤⑥ B.①②③④ C.①③④ D.①③④⑤
网址:http://m.1010jiajiao.com/timu3_id_427772[举报]
阅读所给信息填写以下空白.
(1)人教版(必修1)教材中有如下实验:取两个相同的小木条,分别放入蒸馏水和Na2SiO3饱和溶液中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,同时分别放置在酒精灯外焰处.观察到的现象如下表:
请据此回答设计实验①的目的是 .
(2)最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你所学的氧化还原反应知识,用离子方程式表示产生氯气的原因: .
(3)已知向偏铝酸钠溶液中加入稀盐酸有氢氧化铝生成.某同学却根据所学知识,提出不能使用该方法制取A1(OH)3,理由为 (用简要的文字说明).请你另举出一种制取A1(OH)3的合理方法,该反应的离子方程式为 .
查看习题详情和答案>>
(1)人教版(必修1)教材中有如下实验:取两个相同的小木条,分别放入蒸馏水和Na2SiO3饱和溶液中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,同时分别放置在酒精灯外焰处.观察到的现象如下表:
| 编号 | 实验 | 现象 |
| ① | 放入蒸馏水 | 木条燃烧 |
| ② | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
(2)最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你所学的氧化还原反应知识,用离子方程式表示产生氯气的原因:
(3)已知向偏铝酸钠溶液中加入稀盐酸有氢氧化铝生成.某同学却根据所学知识,提出不能使用该方法制取A1(OH)3,理由为
苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,反应式如图1:某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理如图2:重结晶过程:溶解-→活性炭脱色-→趁热过滤-→冷却结晶-→抽滤-→洗涤-→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小.请根据以上信息,回答下列问题:
(1)萃取分离苯甲醇与苯甲酸钠时,合适的萃取剂是______,其理由是______.充分萃取并静置分层,打开分液漏斗上口的玻璃塞后,上下层分离的正确操作是______.萃取分液后,所得水层用盐酸酸化的目的是______.
(2)苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如图3所示:
重结晶时,合适的溶剂是______,其理由是______.重结晶过程中,趁热过滤的作用是______.
洗涤时采用的合适洗涤剂是______.
A.饱和食盐水 B.Na2CO3溶液 C.稀硫酸 D.蒸馏水
(3)为检验合成产物中苯甲酸的含量,称取试样1.220g,溶解后在容量瓶中定容至100mL,移取25.00mL试样溶液,用0.1000mol?L-1 NaOH溶液滴定,滴定至终点时NaOH溶液共消耗24.65mL,则试样中苯甲酸的含量______.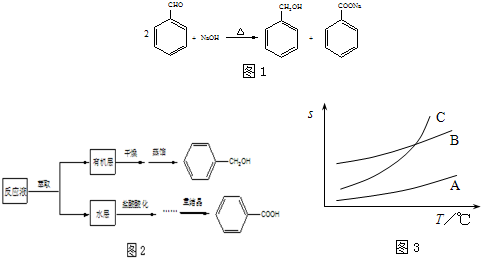
查看习题详情和答案>>
苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,反应式如图1:某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理如图2:重结晶过程:溶解-→活性炭脱色-→趁热过滤-→冷却结晶-→抽滤-→洗涤-→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小.请根据以上信息,回答下列问题:
(1)萃取分离苯甲醇与苯甲酸钠时,合适的萃取剂是______,其理由是______.充分萃取并静置分层,打开分液漏斗上口的玻璃塞后,上下层分离的正确操作是______.萃取分液后,所得水层用盐酸酸化的目的是______.
(2)苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如图3所示:
重结晶时,合适的溶剂是______,其理由是______.重结晶过程中,趁热过滤的作用是______.
洗涤时采用的合适洗涤剂是______.
A.饱和食盐水 B.Na2CO3溶液 C.稀硫酸 D.蒸馏水
(3)为检验合成产物中苯甲酸的含量,称取试样1.220g,溶解后在容量瓶中定容至100mL,移取25.00mL试样溶液,用0.1000mol?L-1 NaOH溶液滴定,滴定至终点时NaOH溶液共消耗24.65mL,则试样中苯甲酸的含量______.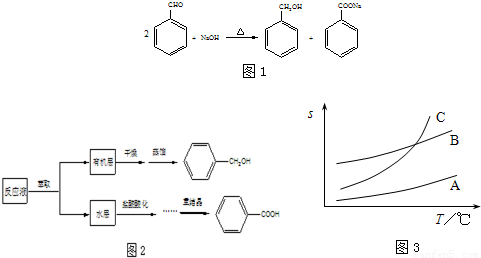
查看习题详情和答案>>
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小.请根据以上信息,回答下列问题:
(1)萃取分离苯甲醇与苯甲酸钠时,合适的萃取剂是______,其理由是______.充分萃取并静置分层,打开分液漏斗上口的玻璃塞后,上下层分离的正确操作是______.萃取分液后,所得水层用盐酸酸化的目的是______.
(2)苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如图3所示:
重结晶时,合适的溶剂是______,其理由是______.重结晶过程中,趁热过滤的作用是______.
洗涤时采用的合适洗涤剂是______.
A.饱和食盐水 B.Na2CO3溶液 C.稀硫酸 D.蒸馏水
(3)为检验合成产物中苯甲酸的含量,称取试样1.220g,溶解后在容量瓶中定容至100mL,移取25.00mL试样溶液,用0.1000mol?L-1 NaOH溶液滴定,滴定至终点时NaOH溶液共消耗24.65mL,则试样中苯甲酸的含量______.

查看习题详情和答案>>
(2012?宜春模拟)一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
(1)①请根据上述信息判断下列反应不能发生的是
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.2HCN+Na2CO3-→2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液 ②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体 ③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.根据上述反应,总结出复分解反应发生的另一规律为
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol?L-1,则该电解质可能是
A. CuSO4 B. HCl C. Na2S D.NaOH E.K2SO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×l0-3mol.L-1的氨水b L;
②c(OH -)=1.0×10-3mol.L-l的氨水c L;
③c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的关系是:
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是
(6)己知常温时Ksp(AgCl)=1.8×10-10mol2?L-2,向50mL 0.018mol?L-1的AgNO3溶液中加入相同体积0.020mol?L-1的盐酸,则c(Ag+)=
查看习题详情和答案>>
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
BC
BC
(填编号).A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.2HCN+Na2CO3-→2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为
A->B2->HB-
A->B2->HB-
.(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液 ②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体 ③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.根据上述反应,总结出复分解反应发生的另一规律为
由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行
由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行
.(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol?L-1,则该电解质可能是
CD
CD
(填序号).A. CuSO4 B. HCl C. Na2S D.NaOH E.K2SO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×l0-3mol.L-1的氨水b L;
②c(OH -)=1.0×10-3mol.L-l的氨水c L;
③c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的关系是:
b>a=d>c
b>a=d>c
.(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是
③
③
(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1>
>
n2(填“>”、“<”或“=”).(6)己知常温时Ksp(AgCl)=1.8×10-10mol2?L-2,向50mL 0.018mol?L-1的AgNO3溶液中加入相同体积0.020mol?L-1的盐酸,则c(Ag+)=
1.8×10-7mol/L
1.8×10-7mol/L
,此时所得混合溶液的pH=2
2
.(2010?浙江)苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,反应式如图1:某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理如图2:重结晶过程:溶解-→活性炭脱色-→趁热过滤-→冷却结晶-→抽滤-→洗涤-→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小.请根据以上信息,回答下列问题:
(1)萃取分离苯甲醇与苯甲酸钠时,合适的萃取剂是
(2)苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如图3所示:
重结晶时,合适的溶剂是
洗涤时采用的合适洗涤剂是
A.饱和食盐水 B.Na2CO3溶液 C.稀硫酸 D.蒸馏水
(3)为检验合成产物中苯甲酸的含量,称取试样1.220g,溶解后在容量瓶中定容至100mL,移取25.00mL试样溶液,用0.1000mol?L-1 NaOH溶液滴定,滴定至终点时NaOH溶液共消耗24.65mL,则试样中苯甲酸的含量
查看习题详情和答案>>
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小.请根据以上信息,回答下列问题:
(1)萃取分离苯甲醇与苯甲酸钠时,合适的萃取剂是
乙醚
乙醚
,其理由是苯甲醇在乙醚中的溶解度大于在水中的溶解度,且乙醚与水互不相溶
苯甲醇在乙醚中的溶解度大于在水中的溶解度,且乙醚与水互不相溶
.充分萃取并静置分层,打开分液漏斗上口的玻璃塞后,上下层分离的正确操作是从下口放出下层液体,从上口倒出上层液体
从下口放出下层液体,从上口倒出上层液体
.萃取分液后,所得水层用盐酸酸化的目的是将苯甲酸钠转化为苯甲酸,析出晶体
将苯甲酸钠转化为苯甲酸,析出晶体
.(2)苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如图3所示:
重结晶时,合适的溶剂是
C
C
,其理由是随温度升高溶解度增加较快
随温度升高溶解度增加较快
.重结晶过程中,趁热过滤的作用是除去不溶性杂质,防止苯甲酸冷却后结晶析出
除去不溶性杂质,防止苯甲酸冷却后结晶析出
.洗涤时采用的合适洗涤剂是
D
D
.A.饱和食盐水 B.Na2CO3溶液 C.稀硫酸 D.蒸馏水
(3)为检验合成产物中苯甲酸的含量,称取试样1.220g,溶解后在容量瓶中定容至100mL,移取25.00mL试样溶液,用0.1000mol?L-1 NaOH溶液滴定,滴定至终点时NaOH溶液共消耗24.65mL,则试样中苯甲酸的含量
98.60%
98.60%
.