摘要:15.⑴Fe(OH)3 ⑵漏斗.玻璃棒.烧杯 ⑶3.2-6.4 ⑷抑制Zn2+水解 ⑸冷却结晶
网址:http://m.1010jiajiao.com/timu3_id_426991[举报]
(2013?烟台一模)某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程: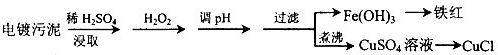
(1)酸浸后加入H2O2的目的是
(2)煮沸CuSO4溶液的原因是
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol?L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol?L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+.通过计算说明该CuCl样品
(4)25℃时,KSP[Fe(OH)3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为
查看习题详情和答案>>
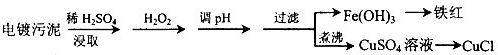
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的PH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的PH | 3.2 | 9.7 | 6.4 |
将Fe2+氧化成Fe3+.便于调整PH值与Cu2+分离
将Fe2+氧化成Fe3+.便于调整PH值与Cu2+分离
.调pH步骤中加入的试剂最好是CuO、或Cu(OH)2、或CuCO3
CuO、或Cu(OH)2、或CuCO3
(填化学式).实验室进行过滤操作所用到的玻璃仪器有漏斗、烧杯、玻璃棒
漏斗、烧杯、玻璃棒
.(2)煮沸CuSO4溶液的原因是
除净溶液中的H2O2,避免影响下一步CuCl的生成
除净溶液中的H2O2,避免影响下一步CuCl的生成
.向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4
2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4
.(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准.称取所制备的CuCl样品0.2500g置于一定量的0.5mol?L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol?L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液24.60mL.有关的化学反应为:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+.通过计算说明该CuCl样品
符合
符合
(填“符合”或“不符合”)国家标准.(4)25℃时,KSP[Fe(OH)3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数为
2.5×10-5
2.5×10-5
.(2013?珠海一模)现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下:
有关氢氧化物完全沉淀的pH见下表
(l)在酸浸过程中,要提高浸出率,可以采取
(2)上述流程中多处涉及“过滤’,实验室中过滤操作需要使用的玻璃仪器有
(3)在“除杂Ⅰ”步骤中,将溶液调至pH=4的目的是
在“除杂Ⅱ”后,溶液的pH约为6,则此步过滤时滤渣中含有
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式
(5)从滤液中提取NaNO3晶体的操作步骤为
(6)在实验室如何洗涤过滤出的碱式碳酸锌?
查看习题详情和答案>>

有关氢氧化物完全沉淀的pH见下表
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
加热、搅拌
加热、搅拌
措施.(2)上述流程中多处涉及“过滤’,实验室中过滤操作需要使用的玻璃仪器有
烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
.(3)在“除杂Ⅰ”步骤中,将溶液调至pH=4的目的是
使三价铁转化为氢氧化铁沉淀除去
使三价铁转化为氢氧化铁沉淀除去
.在“除杂Ⅱ”后,溶液的pH约为6,则此步过滤时滤渣中含有
Cu、Fe
Cu、Fe
.(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式
2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3
2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3
.(5)从滤液中提取NaNO3晶体的操作步骤为
蒸发浓缩、冷却结晶、过滤
蒸发浓缩、冷却结晶、过滤
.(6)在实验室如何洗涤过滤出的碱式碳酸锌?
往漏斗中加入少量的蒸馏水,浸没沉淀,让其自然滤出,反复几次
往漏斗中加入少量的蒸馏水,浸没沉淀,让其自然滤出,反复几次
.“烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子.在实验室中由“烂板液”制取ZnSO4?7H2O的过程如下:
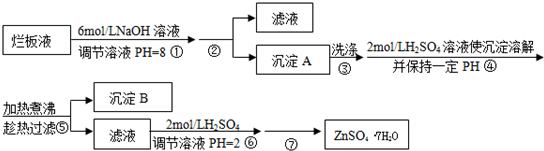
已知有关金属离子形成氢氧化物沉淀时的PH见下表:
(1)第①反应是使Zn2+、Fe3+沉淀,检验Fe3+是否沉淀完全的操作是
(2)第②步操作中需要的玻璃仪器有
(3)第④步中PH应保持在
(4)第⑥步调节溶液PH=2的目的是
(5)操作⑦包含3个基本实验操作,它们是
查看习题详情和答案>>

已知有关金属离子形成氢氧化物沉淀时的PH见下表:
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 6.4 | 8.0 |
取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3 沉淀完全
取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3 沉淀完全
.(2)第②步操作中需要的玻璃仪器有
漏斗、玻璃棒、烧杯
漏斗、玻璃棒、烧杯
.(3)第④步中PH应保持在
3.2~6.4
3.2~6.4
.(4)第⑥步调节溶液PH=2的目的是
抑制Zn2+水解
抑制Zn2+水解
.(5)操作⑦包含3个基本实验操作,它们是
蒸发浓缩
蒸发浓缩
、冷却结晶(或降温结晶)
冷却结晶(或降温结晶)
和过滤.(2009?静安区二模)利用化工厂生产硼砂的废渣--硼镁泥可制取七水硫酸镁(MgSO4?7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2 两种盐的溶解度(g/100g水)
硼镁泥制取七水硫酸镁的工艺流程如下:
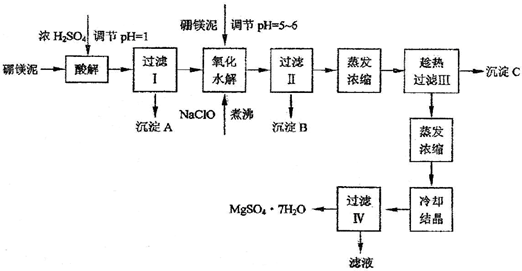
根据以上流程图并参考pH数据和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是
a.被钝化 b.被氧化 c.被溶解
(2)往过滤Ⅰ得到的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液可将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为
(3)沉淀B中除MnO2外还含有
(4)沉淀C的化学式是
(5)过滤出MgSO4?7H2O晶体的滤液中含有的金属阳离子有
查看习题详情和答案>>
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

根据以上流程图并参考pH数据和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是
bc
bc
(选填序号).a.被钝化 b.被氧化 c.被溶解
(2)往过滤Ⅰ得到的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液可将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为
Mn2++ClO-+H2O═MnO2↓+2H++Cl-
Mn2++ClO-+H2O═MnO2↓+2H++Cl-
.加热煮沸的目的是促进Al3+、Fe3+水解
促进Al3+、Fe3+水解
.(3)沉淀B中除MnO2外还含有
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
(填化学式)等物质.(4)沉淀C的化学式是
CaSO4?2H2O或CaSO4
CaSO4?2H2O或CaSO4
;产生沉淀C的操作需趁热进行的原因是以防MgSO4在温度低时结晶析出
以防MgSO4在温度低时结晶析出
;洗涤沉淀需要的玻璃仪器有:烧杯、漏斗、玻璃棒
漏斗、玻璃棒
;若用乙醇代替水作洗涤剂洗涤沉淀C,原因是降低CaSO4?2H2O的溶解度(或减少CaSO4?2H2O的溶解)
降低CaSO4?2H2O的溶解度(或减少CaSO4?2H2O的溶解)
.(5)过滤出MgSO4?7H2O晶体的滤液中含有的金属阳离子有
Mg2+、Na+
Mg2+、Na+
,生产中对该滤液的处理方法是循环利用
循环利用
;检验滤液是否含有SO42-操作是取滤液1~2mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-.
取滤液1~2mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-.
.七水硫酸镁(MgSO4?7H2O)在印染、造纸和医药等工业上都有广泛的应用.可利用化工厂生产硼砂的废渣M(主要成分是MgCO3,还含有MgO、SiO2、Fe2O3、FeO、CaO、Al2O3等杂质)来制取七水硫酸镁.已知:
表1 部分阳离子以氢氧化物形式完全沉淀时的pH
表2 盐的溶解度(单位为 g/100g水)
由废渣M制取七水硫酸镁的工艺流程如下:

回答下列问题:
(1)过滤I的滤液中加入NaClO溶液的目的是
(2)操作Ⅱ所用的玻璃仪器是
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+,其实验方法是
(4)沉淀C的化学式是
查看习题详情和答案>>
表1 部分阳离子以氢氧化物形式完全沉淀时的pH
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度 | 10℃ | 30℃ | 40℃ | 50℃ | 60℃ |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |

回答下列问题:
(1)过滤I的滤液中加入NaClO溶液的目的是
将Fe2+氧化为Fe3+
将Fe2+氧化为Fe3+
,写出反应的离子方程式6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-或2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
,需要加热煮沸的目的是促进Al3+、Fe3+的水解
促进Al3+、Fe3+的水解
.(2)操作Ⅱ所用的玻璃仪器是
烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
.(3)检验过滤Ⅱ后的滤液中是否含有Fe3+,其实验方法是
Fe3++3SCN-=Fe(SCN)3
Fe3++3SCN-=Fe(SCN)3
.(用离子方程式表示).(4)沉淀C的化学式是
CaSO4?2H2O或CaSO4
CaSO4?2H2O或CaSO4
,过滤Ⅲ需趁热过滤的理由是防止MgSO4在温度降低时结晶析出
防止MgSO4在温度降低时结晶析出
.