网址:http://m.1010jiajiao.com/timu3_id_42653[举报]
(1)该反应平衡常数K的表达式为
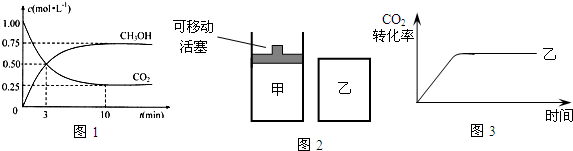
(2)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为
(3)下列措施中能使n(CH3OH)/n(CO2)增大的有
A.升高温度; B.加入催化剂;C.将H2O(g)从体系中分离;D.再充入1mol CO2和3mol H2;
E.充入He(g),使体系总压强增大.
(4)如图2所示,在甲、乙两容器中分别充入物质的量之比为1:3 的CO2和H2,使甲、乙两容器初始容积相等.在相同温度下发生反应,并维持反应过程中温度不变.甲和乙相比,转化程度更大的是
Ⅱ:一定常温下,FeS的KSP=2.5×10-18,H2S饱和溶液在该温度下,[H+]与[S2-]存在着以下关系:[H+]2?[S2-]=1.0×10-21.在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中[Fe2+]达到1mol/L,应调节溶液的pH为
(1)该反应平衡常数K的表达式为______.温度降低,平衡常数K______(填“增大”、“不变”或“减小”).
(2)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为______.
(3)下列措施中能使n(CH3OH)/n(CO2)增大的有______.
A.升高温度;B.加入催化剂;C.将H2O(g)从体系中分离;D.再充入1mol CO2和3mol H2;
E.充入He(g),使体系总压强增大.
(4)如图2所示,在甲、乙两容器中分别充入物质的量之比为1:3的CO2和H2,使甲、乙两容器初始容积相等.在相同温度下发生反应,并维持反应过程中温度不变.甲和乙相比,转化程度更大的是______,且知乙容器中CO2的转化率随时间变化的图象如图3所示,请在图3中画出甲容器中CO2的转化率随时间变化的图象.并请说明以CO2为原料生产燃料甲醇的优点是______(写出一条即可).
Ⅱ:一定常温下,FeS的KSP=2.5×10-18,H2S饱和溶液在该温度下,[H+]与[S2-]存在着以下关系:[H+]2?[S2-]=1.0×10-21.在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中[Fe2+]达到1mol/L,应调节溶液的pH为______(用对数形式表示).(写出计算过程)
(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
| ||
| 高温 |
| ||
| 高温 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ?mol-1;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ?mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
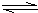 2NH3的△H
2NH3的△H②该反应的化学平衡常数表达式为
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
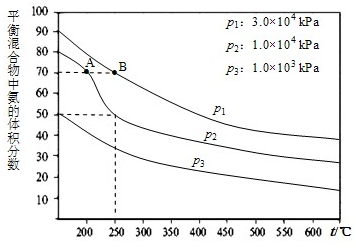 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.(1)右图为合成氨反应,氮气、氢气按体积比为1:3投料时不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数图象.
①若分别用υA(NH3)和υB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则υA(NH3)
②在250℃、1.0×104kPa下,H2的转化率为
③将0.02mol?L-1氨水与0.01mol?L-1的盐酸等体积混合,若反应后混合溶液显碱性,则反应混合液中各离子浓度由大到小的顺序为
(2)NH3(g) 与CO2(g) 经过两步反应生成尿素,两步反应的能量变化示意图如下:
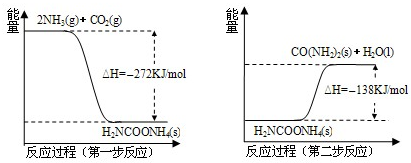
①NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
②工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有
A.升高温度 B.加入催化剂 C.将尿素及时分离出去 D.增大反应体系的压强
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5L的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:
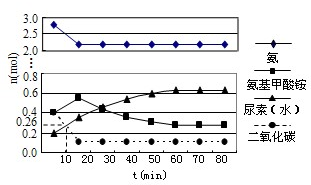
①已知总反应的速率通常由慢的一步反应决定,则合成尿素总反应的速率由第
②反应进行到10min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾履形成的原因。
(1)汽车尾气净化的主要原理为;2NO(g)+2CO(g)  N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____。
A.在单位时问内生成1mol CO2的同时消耗了lmol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
?? 
③若要同时提高该反应的速率和NO的转化率,采取的措施有_____、____。(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应原理为C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应在___下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为____。(已知:H2S: Ka1=9.1×10-8;Ka2=1.1×10-12。H2CO3:Ka1=4.30×10-7;Ka2=5.61×10-11)
(3)已知反应:CO(g)+H2O(g) CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ______0(填“<”或“>”);若在9000C时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时υ正______υ逆(填“<”,“>”,“=”)。
查看习题详情和答案>>