网址:http://m.1010jiajiao.com/timu3_id_424958[举报]
盐酸是应用广泛的酸之一,它具有:①酸性 ②氧化性 ③还原性 ④挥发性。请回答下列问题:
(1)浓盐酸长时间露置在空气中,溶液的质量减轻表现了____________(填序号)。
(2)实验室用稀盐酸和锌粒反应制取氢气表现了____________(填序号),反应的离子方程式为- 。
(3)用盐酸除去铁表面的铁锈表现了____________(填序号),反应的离子方程式为_________________。
(4)实验室常用KMnO4和浓盐酸反应制取Cl2,反应的方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①被还原的元素是____________,还原剂是____________。
②氧化产物是____________,若生成5 mol Cl2,转移的电子总数为____________。
查看习题详情和答案>>(17分)Ⅰ:现有如下物质:①酒精、②铜、③氢氧化钡、④氨气、⑤蔗糖、 ⑥高氯酸、⑦碳酸氢钠、⑧磷酸、⑨硫化氢、⑩Al2(SO4)3。请用物质的序号填写下列空白
(1)属于强电解质的有: 。
(2)液态时能导电且为物理变化的有: 。
(3)⑦在水溶液的电离方程式为 。
Ⅱ:A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。处理C物质可得到有价值的化学品,写出该化学品中的1种酸和1种盐的名称 、 。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是___ _____。写④反应离子方程 。
(4)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 。
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
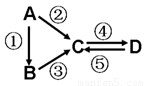
⑴若A是淡黄色固体,C、D是氧化物, C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途 。
⑵若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 。
⑶若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是 。
⑷若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式 。D的化学式是 。
⑸若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式 。
查看习题详情和答案>>
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: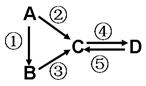
⑴若A是淡黄色固体,C、D是氧化物, C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途 。
⑵若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 。
⑶若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是 。
⑷若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式 。D的化学式是 。
⑸若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式 。
(13分)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: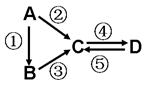
⑴若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要 物质。处理C物质可得到有价值的化学品,写出该化学品中的1种酸和1种盐的名称 、 。
⑵若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式
⑶若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是___ _____。
写④反应离子方程式 。
⑷若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 。