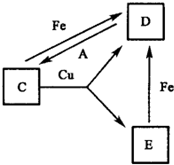
摘要:21.A.B.C.D.E.F六种常见的单质或化合物在一定条件下有如下图所示的相互转化关系.所有反应物和生成物均已给出. (1)若B在常温下为液态,C是一种有磁性的化合物,E是一种无色.无味的有毒气体.则反应③的化学方程式 . (2)若B由两种元素组成.其简单离子的电子层结构相同,绿色植物的光合作用和呼吸作用可实现自然界中D.E的循环.则B的电子式为 .11.6gA和E组成的混合气体与足量的B固体反应.固体增重3.6g.则A.E混合气中E 的体积分数为 . (3)若A和E都是第四周期常见的金属单质.其余都是常见的盐.反应①②③都在溶液中进行.则B.C.F氧化性由强到弱顺序为 .
网址:http://m.1010jiajiao.com/timu3_id_424683[举报]
A、B、C、D、E、F六种常见的单质或化合物在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。

(1)若B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应③的化学方程式______________。
(2)若B由两种元素组成,其简单离子的电子层结构相同;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,11.6gA和E组成的混合气体与足量的B固体反应,固体增重3.6g,则A、E混合气中E 的体积分数为_________________________。
(3)若A和E都是第四周期常见的金属单质,其余都是常见的盐,反应①②③都在溶液中进行,则B、C、F氧化性由强到弱顺序为(用离子符号表示)_________________。
查看习题详情和答案>>
(2)若B由两种元素组成,其简单离子的电子层结构相同;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,11.6gA和E组成的混合气体与足量的B固体反应,固体增重3.6g,则A、E混合气中E 的体积分数为_________________________。
(3)若A和E都是第四周期常见的金属单质,其余都是常见的盐,反应①②③都在溶液中进行,则B、C、F氧化性由强到弱顺序为(用离子符号表示)_________________。
 有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:
有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:①A常温下为黄绿色气体;
②B为淡黄色固体,溶于水同时有无色气体放出;
③C、D所含元素相同,溶液中C、D、E能发生右图所示转化;
④F是一种钾盐,受热时也会产生②中的无色气体,分解剩余固体与浓盐酸共热可生成气体A.
请回答下列问题:
(1)A的电子式为
(2)②中反应的化学方程式为
(3)C、D溶液的颜色依次为
(4)F的化学式是
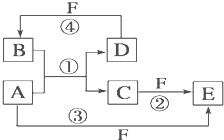 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质(一种黑色固体),且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,则A在周期表中的位置为:
第三周期,ⅡA族
第三周期,ⅡA族
,B的电子式为::O::C::O:
:O::C::O:
,F的浓溶液与D在加热条件下反应的化学方程式为:C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3
CO2↑+4NO2↑+2H2O
.
| ||
(2)若A是常见变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行.则反应②的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(3)若A、D、F都是短周期非金属元素单质,且 A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,则B是
SiO2
SiO2
,C是CO
CO
,F是O2
O2
.(填化学式)A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式
 ;乙为由B元素组成的单质,写出该单质的一种用途
;乙为由B元素组成的单质,写出该单质的一种用途
(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:
 .
.
(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
查看习题详情和答案>>
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式


作保护气
作保护气
.(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
Fe3O4+8H+═2Fe3++Fe2++4H2O
Fe3O4+8H+═2Fe3++Fe2++4H2O
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
NH4NO2+AgNO3═AgNO2↓+NH4NO3
NH4NO2+AgNO3═AgNO2↓+NH4NO3
,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为C(NO2->C(NH4+)>C(H+)>C(OH-)
C(NO2->C(NH4+)>C(H+)>C(OH-)
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:


(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
.为探究该复盐中的某种离子,取少量该复盐于试管中并加水溶解,滴加铁氰化钾溶液(K3[Fe(CN)6]),则现象和结论为出现蓝色沉淀,证明有Fe2+
出现蓝色沉淀,证明有Fe2+
. A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)(1)若A是常见金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时发出苍白色火焰.则F所对应的元素在周期表位置是
第三周期、第ⅦA族
第三周期、第ⅦA族
,反应②(在水溶液中进行)的离子方程式为2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
;(2)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,且③④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为
①
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
,
| ||
④
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
;
| ||
(3)若A、D、F都是短周期非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种能与血红蛋白结合的有毒气体;则物质B的晶体类型是
原子晶体
原子晶体
,分子E的结构式是O=C=O
O=C=O
.