网址:http://m.1010jiajiao.com/timu3_id_423677[举报]
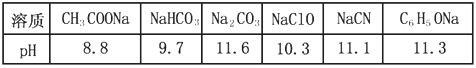
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
下列说法或表达中,正确的是
A.少量二氧化碳通入NaClO溶液中:2NaClO + CO2 + H2O
 Na2CO3 + 2HClO
Na2CO3 + 2HClOB.过量的HCN滴入碳酸钠溶液中HCN + Na2CO3
 NaCN+ NaHCO3
NaCN+ NaHCO3C.结合质子能力由强到弱的顺序为:CO32—>CN—>HCO3—>CH3COO—
D.常温下电离常数:Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN) 查看习题详情和答案>>
B.2HCN+Na2CO3==CO2+2NaCN+H2O
C.结合质子能力由强到弱的顺序为:CO32->HCO3->CH3COO-
D.常温下电离常数比较:Ka (H2CO3)>Ka(CH3COOH)>Ka(C6H5OH)
(1)水是极弱的电解质,也是最重要的溶剂.常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol?L-1,则该电解质可能是______(填序号).
A. CuSO4 B. HCl C. Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HC10)增大,可以采取的措施为(至少回答两种)______.
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3mol.L-1的氨水b L;②c(OH -)=1.0×10-3mol.L-l的氨水c L;③c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L.则a、b、c、d之间的关系是:______.
(4)强酸制弱酸是水溶液中的重要经验规律.
①已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为______.
②某同学将H2S通入CuSO4溶液中发现生成黑色沉淀,查阅资料并在老师的指导下写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4,但这位同学陷入了困惑:这不成了弱酸制取强酸了吗?请你帮助解释______.
(5)已知:H2A═H++HA-、HA-?H++A2-,常温下,0.1mol.L-1的NaH A溶液其pH=2,则0.1mol?L-1的H2A溶液中氢离子浓度的大小范围是:______;NaHA溶液中各种离子浓度大小关系为______.
(6)己知:Ksp(AgCl)=1.8×10-10mol?L-1,向50mL 0.018mo1?L-l的AgNO3溶液中加入相同体积0.020mol?L-1的盐酸,则c(Ag+)=______,此时所得混合溶液的pH=______.
查看习题详情和答案>>
(10分)(1)已知:在常温下,浓度均为0.1mol·L-1的下列六种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
依据复分解反应的规律,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前面描述的信息判断,浓度均为0.05mol·L-1的下列六种物质的溶液中,pH最小的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式: 。
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1 mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图。
查看习题详情和答案>>
甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g) CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
①已知:CH3OH (g)+
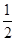 O2 (g)
O2 (g) CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol
CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol H2(g)+
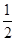 O2 (g)
O2 (g) H2 O(g) ?H2= —120.9kJ/mol
H2 O(g) ?H2= —120.9kJ/mol 则甲醇与水蒸气催化重整反应的焓变△H3=_____ 。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL)
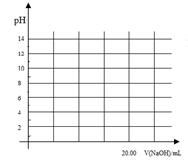 查看习题详情和答案>>
查看习题详情和答案>>