摘要:( )只含极性键的非极性分子是①BF3 ②CCl4 ③NH3 ④H2O ⑤CH3Cl ⑥CS2 ⑦SiO2 ⑧N2 A ①②⑥ B ①②⑥⑦ C ②⑤③ D ①②③⑥
网址:http://m.1010jiajiao.com/timu3_id_423466[举报]
(1)X原子在第二电子层上只有一个空轨道,则X是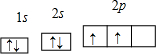
 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是
;R原子的3p轨道上只有一个未成对电子,则R原子可能是
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
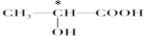
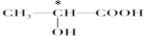
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
查看习题详情和答案>>
C
C
;其轨道表示式为

Al
Al
、Cl
Cl
;Y原子的核电荷数为29,其电子排布式是1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
,其在元素周期表中的位置是第四周期第ⅠB族
第四周期第ⅠB族
,是属于ds
ds
区的元素.(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
Co3+
Co3+
、CN-
CN-
、6
6
.(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.

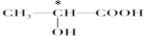
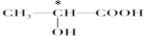
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
①③④⑦
①③④⑦
.(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
>
>
H2SO3; H3PO4>
>
H3PO3.(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
sp3
sp3
杂化,分子的立体构型为V形
V形
.BF3分子中,中心原子的杂化方式为
sp2
sp2
杂化,分子的立体构型为平面正三角形
平面正三角形
.(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
水分子之间存在氢键
水分子之间存在氢键
.(1)X原子在第二电子层上只有一个空轨道,则X是
 ;R原子的3p轨道上只有一个未成对电子,则R原子可能是
;R原子的3p轨道上只有一个未成对电子,则R原子可能是
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
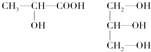
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
查看习题详情和答案>>
C
C
;其轨道表示式为

Al
Al
、Cl
Cl
;Y原子的核电荷数为29,其电子排布式是1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
,其在元素周期表中的位置是第四周期第IB族
第四周期第IB族
,是属于ds
ds
区的元素.(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
Co3+
Co3+
、CN-
CN-
、6
6
.(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
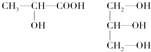
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
①③④⑦
①③④⑦
.(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
>
>
H2SO3; H3PO4>
>
H3PO3.(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
sp3
sp3
杂化,分子的立体构型为V形
V形
.BF3分子中,中心原子的杂化方式为
sp2
sp2
杂化,分子的立体构型为平面正三角形
平面正三角形
.(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
水分子之间存在氢键
水分子之间存在氢键
.