摘要:25. 哈三中2009--2010学年度上学期高三学年九月考试
网址:http://m.1010jiajiao.com/timu3_id_423413[举报]
哈三中某课外活动小组改进铜与浓硫酸反应的实验,制备并验证二氧化硫的性质,请回答下列问题:
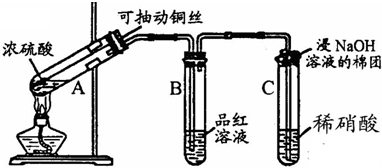
(1)铜丝在实验中的作用:
(2)实验过程中在装置C中会看到什么现象?
(3)已知反应:2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是
A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=
若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡
但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度
查看习题详情和答案>>

(1)铜丝在实验中的作用:
控制反应的开始和停止
控制反应的开始和停止
.(2)实验过程中在装置C中会看到什么现象?
生成无色气体并变为红棕色
生成无色气体并变为红棕色
;请用化学方程式解释:SO2+HNO3=H2SO4+NO2NO+02=2NO2
SO2+HNO3=H2SO4+NO2NO+02=2NO2
.(3)已知反应:2SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是C
C
.A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=
0.06mol/L?min-1
0.06mol/L?min-1
.若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡
不移动
不移动
(填“正向移动”、“逆向移动”、“不移动”、“无法确定”).但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度
减小
减小
.(填“填大”、“不变”或“减小”),O2的转化率减小
减小
(填“升高”、“不变”或“降低”),SO2的体积分数减小
减小
(填“增大”、“不变”或“减小”).哈三中某课外活动小组改进铜与浓硫酸反应的实验,制备并验证二氧化硫的性质,请回答下列问题:

(1)铜丝在实验中的作用:______.
(2)实验过程中在装置C中会看到什么现象?______;请用化学方程式解释:______.
(3)已知反应:2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=______.
若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡______(填“正向移动”、“逆向移动”、“不移动”、“无法确定”).
但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度______.(填“填大”、“不变”或“减小”),O2的转化率______(填“升高”、“不变”或“降低”),SO2的体积分数______(填“增大”、“不变”或“减小”).
查看习题详情和答案>>
哈三中某课外活动小组改进铜与浓硫酸反应的实验,制备并验证二氧化硫的性质,请回答下列问题:

(1)铜丝在实验中的作用:______.
(2)实验过程中在装置C中会看到什么现象?______;请用化学方程式解释:______.
(3)已知反应:2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=______.
若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡______(填“正向移动”、“逆向移动”、“不移动”、“无法确定”).
但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度______.(填“填大”、“不变”或“减小”),O2的转化率______(填“升高”、“不变”或“降低”),SO2的体积分数______(填“增大”、“不变”或“减小”).
查看习题详情和答案>>

(1)铜丝在实验中的作用:______.
(2)实验过程中在装置C中会看到什么现象?______;请用化学方程式解释:______.
(3)已知反应:2SO2(g)+O2(g)
 2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=______.
若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡______(填“正向移动”、“逆向移动”、“不移动”、“无法确定”).
但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度______.(填“填大”、“不变”或“减小”),O2的转化率______(填“升高”、“不变”或“降低”),SO2的体积分数______(填“增大”、“不变”或“减小”).
查看习题详情和答案>>
哈三中某课外活动小组改进铜与浓硫酸反应的实验,制备并验证二氧化硫的性质,请回答下列问题:
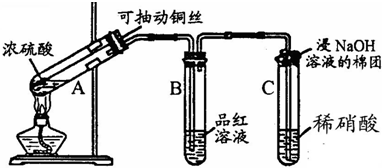
(1)铜丝在实验中的作用:______.
(2)实验过程中在装置C中会看到什么现象?______;请用化学方程式解释:______.
(3)已知反应:2SO2(g)+O2(g)

2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=______.
若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡______(填“正向移动”、“逆向移动”、“不移动”、“无法确定”).
但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度______.(填“填大”、“不变”或“减小”),O2的转化率______(填“升高”、“不变”或“降低”),SO2的体积分数______(填“增大”、“不变”或“减小”).
查看习题详情和答案>>

(1)铜丝在实验中的作用:______.
(2)实验过程中在装置C中会看到什么现象?______;请用化学方程式解释:______.
(3)已知反应:2SO2(g)+O2(g)

2SO3(g)△H=-196.6kJ?mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是______.
A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
(4)将0.23mol SO2和0.11mol O2放入容积为1L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=______.
若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡______(填“正向移动”、“逆向移动”、“不移动”、“无法确定”).
但若保持温度不变,只通入1.00mol O2,则重新达到平衡时,SO2的平衡浓度______.(填“填大”、“不变”或“减小”),O2的转化率______(填“升高”、“不变”或“降低”),SO2的体积分数______(填“增大”、“不变”或“减小”).
哈三中某课外活动小组改进铜与浓硫酸反应的实验,制备并验证二氧化硫的性质,请回答下列问题:

⑴铜丝在实验中的作用:___________.
⑵实验过程中在装置C中会看到什么现象?__________请用化学方程式解释:___________。
⑶已知反应:2SO2(g)+O2(g)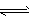 2SO3(g) △H=-196.6kJ·mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是____。
2SO3(g) △H=-196.6kJ·mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是____。
A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
⑷将0.23 mol SO2和0.11 mol O2放入容积为1 L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12 mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=_______________。若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡_____________(填“正向移动”、“逆向移动”、“不移动”、“无法确定”)。但若保持温度不变,只通入1.00 mol O2,则重新达到平衡时,SO2的平衡浓度_______。(填“填大”、“不变”或“减小”),O2的转化率_________(填“升高”、“不变”或“降低”),SO2的体积分数______(填“增大”、“不变”或“减小”)。
查看习题详情和答案>>
⑵实验过程中在装置C中会看到什么现象?__________请用化学方程式解释:___________。
⑶已知反应:2SO2(g)+O2(g)
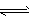 2SO3(g) △H=-196.6kJ·mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是____。
2SO3(g) △H=-196.6kJ·mol-1,在一恒温恒容容器中投入一定量的SO2和O2,经过一段时间一定能证明该反应已达平衡状态的是____。 A.混合气体密度保持不变
B.c(SO2):c(O2):c(SO3)=2:1:2
C.容器内气体分子总数不随时间变化
D.相同时间内,消耗2n mol SO2的同时消耗n mol O2
⑷将0.23 mol SO2和0.11 mol O2放入容积为1 L的密闭容器中,在一定温度下,经过2min反应达到平衡,得到0.12 mol SO3.则用SO2浓度变化来表示反应速率为υ(SO2)=_______________。若此时保持温度不变,同时通入0.12mol SO3和 0.15mol O2,则平衡_____________(填“正向移动”、“逆向移动”、“不移动”、“无法确定”)。但若保持温度不变,只通入1.00 mol O2,则重新达到平衡时,SO2的平衡浓度_______。(填“填大”、“不变”或“减小”),O2的转化率_________(填“升高”、“不变”或“降低”),SO2的体积分数______(填“增大”、“不变”或“减小”)。