摘要:2 L容器中.分别将物质的量均为2.00 mol的SO2.O2混合.在不同温度(T)下发生如下反应:2SO2(g)+O2(g) 2SO3(g).并在第10 s时分别测定其中SO3的体积分数(SO3%)并绘成如图所示曲线: (1)此反应的正反应为 热反应, (2)A.B两点正反应速率的大小关系是:vA vB,以O2表示T0对应的平均反应速率(O2)= , (3)温度T<T0时.SO3%逐渐增大的原因是 , (4)若B点SO3的体积分数为40.0%.则SO2的转化率为 , (5)若将B点的混合气体的5%通入过量的BaCl2溶液.生成沉淀 g.
网址:http://m.1010jiajiao.com/timu3_id_423364[举报]
2 L容器中,分别将物质的量均为2.00 mol的SO2、O2混合,在不同温度(T)
下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g)。并
2SO3(g)。并
在第10 s时分别测定其中SO3的体积分数(SO3%)
并绘成如图所示曲线:

(1)此反应的正反应为 热反应;
(2)A、B两点正反应速率的大小关系是:vA vB
(填=、>或<,);以O2表示T0对应的平均反应速率![]() (O2)= ;
(O2)= ;
(3)温度T<T0时,SO3%逐渐增大的原因是
;
(4)若B点SO3的体积分数为40.0%,则SO2的转化率为 ;
(5)若将B点的混合气体的5%通入过量的BaCl2溶液,生成沉淀 g。
查看习题详情和答案>>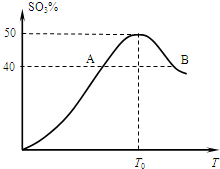 2L容器中,分别将物质的量均为2.00mol的SO2、O2混合,在不同温度(T)下发生如下反应:2SO2(g)+O2(g)?2SO3(g).并在第10s时分别测定其中SO3的物质的量分数(SO3%)并绘成如图所示曲线:
2L容器中,分别将物质的量均为2.00mol的SO2、O2混合,在不同温度(T)下发生如下反应:2SO2(g)+O2(g)?2SO3(g).并在第10s时分别测定其中SO3的物质的量分数(SO3%)并绘成如图所示曲线:(1)以O2表示T0对应的平均反应速率
. | v |
0.04 mol/(L?s)
0.04 mol/(L?s)
;(2)若B点SO3的物质的量分数为40.0%,则SO2的转化率为
66.7%
66.7%
.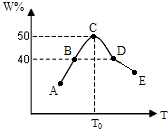 将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.
将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.(1)前10sB容器中的平均反应速率v(Y)=
2.7×10-2mol/L?s
2.7×10-2mol/L?s
;此反应的正反应为放
放
热反应;(2)10s时A容器中v正
>
>
v逆(填=、>或<,下同);B、D两容器中正反应速率关系vB<
<
vD.(3)若10s时C点生成物W的体积分数为50.0%,则X的转化率为
66.7%
66.7%
.(4)若10s时保持E容器的温度与体积不变,向E容器中中通入0.6molW,要求重新达到平衡时混合物中各组分的百分含量不变,则此时还需同时通入
0.2
0.2
mol反应物Y.