网址:http://m.1010jiajiao.com/timu3_id_422266[举报]
资料显示不同浓度的硫酸与锌反应时,
 硫酸可以被还原为SO2,也可被还原为氢气。为
硫酸可以被还原为SO2,也可被还原为氢气。为
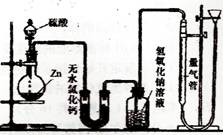
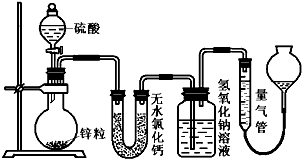
了验证这一事实,某同学拟用下图装置进行实验
(实验时压强为10lkPa,温度为0℃)。
(1)若在烧瓶放入1.30g锌粒,与c mol/L H2SO4
反应,为保证实验结论的可靠,在洗气瓶中
加入1mol/L NaOH溶液的体积V≥_______mL,
量气管的适宜规格是_____________mL。 (选填:200,400,500)。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则发生反立的化学方程式
为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集裂VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是;
____________________________________________________________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
查看习题详情和答案>>(16分)资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
(1)若在烧瓶中放入1.30g锌粒,与cmol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________(选填:200,400,500) mL 。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到 VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意: 、 、 。
查看习题详情和答案>>
(16分)资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
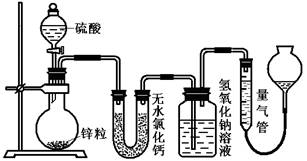
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ (选填:200,400,500) mL 。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到 VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意: 、 、 。
查看习题详情和答案>>
资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃).
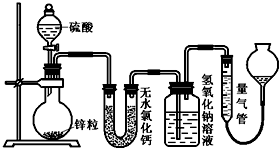
(1)若在烧瓶放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,在洗气瓶中加入1mol/L NaOH溶液的体积V≥______mL,量气管的适宜规格是______ (选填:200,400,500)mL.
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则发生反应的化学方程式为:______
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到VmL气体,则有: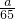 =______.
=______.
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,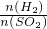 =______(用含字母的代数式表示).
=______(用含字母的代数式表示).
查看习题详情和答案>>
__________。
A.200 mL B.400 mL C.500 mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:
________________________。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:
ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)若撤走盛有无水氯化钙的U形管,n(H2)/n(SO2)的数值将__________ (填“偏大”“偏小”或“无影响”) 。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:___________________、
_________________、__________________。