题目内容
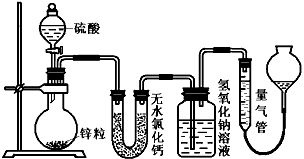
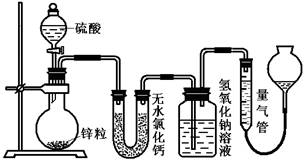
(16分)资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
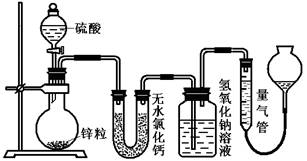
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ (选填:200,400,500) mL 。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到 VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意: 、 、 。
【答案】
(1)20(3分) 500(3分)
(2)Zn+2H2SO4(浓)=ZnSO4+SO2+2H2O(3分)
(3)得失电子守恒(3分) (4)(64cV-2m)/m(4分)
【解析】

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
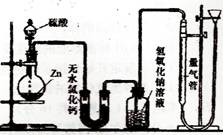 硫酸可以被还原为SO2,也可被还原为氢气。为
硫酸可以被还原为SO2,也可被还原为氢气。为