摘要:19.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素. 试回答下列问题: (1)元素p为26号元素.请写出其基态原子电子排布式 . (2)d与a反应的产物的分子中中心原子的杂化形式为 . (3)h的单质在空气中燃烧发出耀眼的白光.请用原子结构的知识解释发光的原因: . (4)o.p两元素的部分电离能数据列于表: 元素 o P 电离能/kJ·mol-1 I1 717 759 I2 1509 1561 I3 3248 2957 比较两元素的I2.I3可知.气态o2+再失去一个电子比气p2+再失去一个电子.对此.你的解释是 . (5)i单质晶体中原子的堆积方式如下图甲所示.其晶胞特征如下图乙所示.原子之间相互位置关系的平面图如下图丙所示.则晶胞中i原子的配位数为 . (6)元素a.c.e可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成 个键. 个键. (7)第三周期8种元素按单质熔点高低的顺序如下图.其中电负性最大的是 . (8)短周期某主族元素M的电离能情况如下图所示.则M元素是述周期表的 元素.
网址:http://m.1010jiajiao.com/timu3_id_421991[举报]
下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素

(1)下列
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响.
原子核失去核外不同电子所需的能量(KJ?mol-1)
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量
②表中X可能为13种元素中的
③Y是周期表中
④以上13种元素中,
(3)g元素原子基态时的核外电子排布式为
查看习题详情和答案>>

(1)下列
①④
①④
(填写编号)组元素的单质可能都是电的良导体.①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响.
原子核失去核外不同电子所需的能量(KJ?mol-1)
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
.②表中X可能为13种元素中的
a
a
(填写字母)元素.用元素符号表示X和j形成的化合物的化学式Na2O或Na2O2
Na2O或Na2O2
.③Y是周期表中
ⅢA
ⅢA
族的元素.④以上13种元素中,
m
m
(填写字母)元素原子失去核外第一个电子需要的能量最多.(3)g元素原子基态时的核外电子排布式为
1s22s22p63s23p63d104s24p2
1s22s22p63s23p63d104s24p2
.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出字母O代表的元素符号
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(4)k与l形成的化合物kl2的电子式是
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于
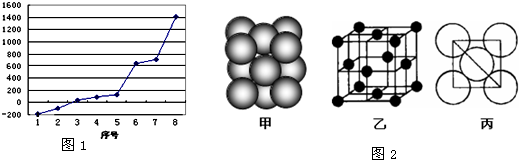
(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
(用M、NA、d表示).
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||

试回答下列问题:
(1)请写出字母O代表的元素符号
Fe
Fe
,该元素在周期表中的位置第四周期第 VIII族
第四周期第 VIII族
.(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
Si
Si
(填元素符号);其中电负性最大的是2
2
(填如图1中的序号).(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.(4)k与l形成的化合物kl2的电子式是


分子
分子
晶体.(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
4
4
,该晶体的密度_
| ||
| 8NAd3 |
| ||
| 8NAd3 |
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
试回答下列问题: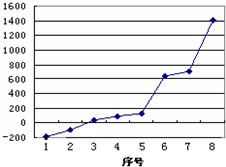
(1)请写出元素o的+3价阳离子基态电子排布式
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(3)由j原子跟d原子相互交替结合而形成一种坚硬难熔的晶体,该晶体中一个d原子与
(4)化合物kl2的中心原子杂化类型
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||

(1)请写出元素o的+3价阳离子基态电子排布式
1s22s22p63s23p63d5
1s22s22p63s23p63d5
.(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
Si
Si
(填元素符号);其中电负性最大的是2
2
(填右图中的序号).(3)由j原子跟d原子相互交替结合而形成一种坚硬难熔的晶体,该晶体中一个d原子与
3
3
个j原子成键,1mol该晶体中含12NA
12NA
个j-d键.(4)化合物kl2的中心原子杂化类型
sp3
sp3
,它在常温形成晶体时,属于分子
分子
晶体.下表是元素周期表的一部分,表中所列的字母分别代表一种元素.
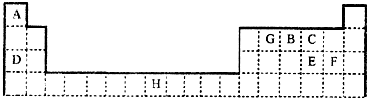
请回答下列问题:
(1)元素H位于元素周期表的 区,其原子结构示意图为 .
(2)在A、B、C、D、E、F、G送7种元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种.
(3)元素D与E形成的化合物D2E的水溶液的pH≠7,原因是 (用离子方程式表示).在工业上用惰性电极电解DF的饱和溶液时,阴极的电极反应式为 .
(4)王水(浓消酸和浓盐酸以体积比1:3混合而成)可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的化合物BCF等,若BCF分子的所有原子都达到8电子结构,则BCF的电子式为 (用对应的元素符号表示).
(5)已知化合物H(GC)5,常温下呈液态,熔点为-20.5℃、沸点为103℃,易溶于非极性溶剂.据此可判断该化合物晶体为 .
查看习题详情和答案>>

请回答下列问题:
(1)元素H位于元素周期表的
(2)在A、B、C、D、E、F、G送7种元素中,基态原子中未成对电子数与其所在周期数相同的元素有
(3)元素D与E形成的化合物D2E的水溶液的pH≠7,原因是
(4)王水(浓消酸和浓盐酸以体积比1:3混合而成)可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的化合物BCF等,若BCF分子的所有原子都达到8电子结构,则BCF的电子式为
(5)已知化合物H(GC)5,常温下呈液态,熔点为-20.5℃、沸点为103℃,易溶于非极性溶剂.据此可判断该化合物晶体为

