网址:http://m.1010jiajiao.com/timu3_id_421401[举报]
氧化还原反应在生产和生活中使用非常广泛。
I(4分)、一个体重50 kg的健康人含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是__________。
A. Fe B. Fe2+ C. Fe3+
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。下列也能实现这种转化的物质是________。
A. Cl2 B. O2 C. FeCl3 D.浓硫酸
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________性。
II(8分)、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As——砷)
![]() (1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
(1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
![]() (2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
![]() (3)根据上述反应可推知 。
(3)根据上述反应可推知 。
![]() a.氧化性:
a.氧化性:![]() b.氧化性:
b.氧化性:![]()
![]() c.还原性:
c.还原性:![]() d.还原性:
d.还原性:![]()
![]() (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方![]() 向和数目:
向和数目:
 如图为2H2+O2?2H2O的能量变化示意图,据此判断下列说法正确的是( )
如图为2H2+O2?2H2O的能量变化示意图,据此判断下列说法正确的是( )| A、过程①吸收能量 | B、过程②吸收能量 | C、此反应中反应物的总能量低于生成物的总能量 | D、该反应为吸热反应 |
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol?L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是
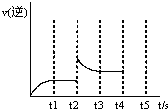
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是
(4)下列哪些情况表明容器中已达平衡状态
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍.
(2)将25g A、5g B和10g C的混合物加热,充分反应后,分析混合物成分,其中含A 10g、C 21g,还有一种新物质D,则该反应中反应物的质量比为
(3)已知:MnO2+4HCl (浓)
| ||
 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述中正确的是( )