摘要: 有关原子结构常用规律总结 ⑴ 质量关系:质量数(A)=质子数(Z)+中子数(N) ⑵ 电性关系:原子:核电荷数=质子数=核外电子数 阴离子:质子数=核外电子数-电荷数 阳离子:质子数=核外电子数+电荷数
网址:http://m.1010jiajiao.com/timu3_id_42096[举报]
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是_________________________________________;
31Ga的第一电离能却明显低于30Zn,原因是______________________________________;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为________________。NH3 分子中N原子的杂化方式为_______杂化,NH3分子的空间立体构型是____________。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是:__________________________________________(用相关的离子方程式和简单的文字说明加以解释)
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是________。

(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度
为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
查看习题详情和答案>>
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是_________________________________________;
31Ga的第一电离能却明显低于30Zn,原因是______________________________________;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为________________。NH3 分子中N原子的杂化方式为_______杂化,NH3分子的空间立体构型是____________。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是:__________________________________________(用相关的离子方程式和简单的文字说明加以解释)
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是________。

(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度
为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是_________________________________________;
31Ga的第一电离能却明显低于30Zn,原因是______________________________________;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为________________。NH3 分子中N原子的杂化方式为_______杂化,NH3分子的空间立体构型是____________。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是:__________________________________________(用相关的离子方程式和简单的文字说明加以解释)
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是________。

(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度
为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池.工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下.
反应Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1
反应Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2 (△H2<0=
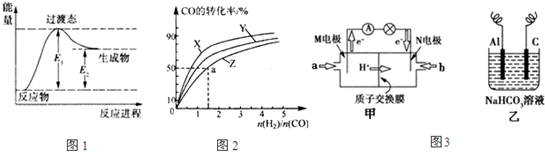
(1)图1是反应Ⅰ进行过程中的能量变化示意图.根据图象判断,升高温度,反应I的平衡常数将 (填“增大”、“减小”或“不变”).
(2)已知在催化剂和一定压强下,反应Ⅱ能自发进行.在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.
图2是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是 ;该温度下上述反应的化学平衡常数为 .
(3)图3甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2
2CO2+4H2O.
①M电极的电极反应式为 .
②以上述电池做电源,用图3乙所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示): .Al电极应接燃料电池的 (填“M”或“N”)极.
(4)合成甲醇时可选用CuCl为催化剂.CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu═2CuCl.在实验过程中应先加入浓盐酸,发生反应CuCl+HCl?H[CuCl2].反应结束后将溶液倒入蒸馏水中有CuCl生成.实验过程中加入浓盐酸的目的是 .当c(Cl-)=2×10-3mol?L-1时,c(Cu+)= mol?L-1.已知:Ksp(CuCl)=1.7×10-7.
查看习题详情和答案>>

反应Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1
反应Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2 (△H2<0=
(1)图1是反应Ⅰ进行过程中的能量变化示意图.根据图象判断,升高温度,反应I的平衡常数将
(2)已知在催化剂和一定压强下,反应Ⅱ能自发进行.在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.
图2是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是
(3)图3甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2
| ||
①M电极的电极反应式为
②以上述电池做电源,用图3乙所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示):
(4)合成甲醇时可选用CuCl为催化剂.CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu═2CuCl.在实验过程中应先加入浓盐酸,发生反应CuCl+HCl?H[CuCl2].反应结束后将溶液倒入蒸馏水中有CuCl生成.实验过程中加入浓盐酸的目的是