摘要:乙二酸俗称草酸.分子式H2C2O4,是一种重要的有机化工原料.某学习小组对乙二酸的有关性质进行了探究.请你参与其中并回答有关问题· I.探究乙二酸的热稳定性 通过查阅资料知道.乙二酸不稳定.受热时易发生分解.相应的化学方程式为: HOOC-COOH H2O+CO2↑+CO↑ 学习小组拟用下图提供的仪器和试剂.设计一个实验.来证明乙二酸的受热分解产物中有CO2和CO (1)用字母表示接口的正确连接顺序.括号可不填满.也可补充: a→b→c→→→-- (2)证明分解产物中有CO的实验依据是 . (3)指导老师认为同学们用上图提供的仪器和试剂做实验时.存在一些欠缺.请你帮忙指出来 . II.探究乙二酸的还原性 准确称取Wg草酸晶体(H2C2O4·2 H2O).溶于水配成500mL溶液.取25.00mL置于锥形瓶中.用酸性高锰酸钾溶液滴定至终点.消耗高锰酸钾溶液VmL.(已知:①MnO4-在酸性环境下的还原产物是) (4)滴定时发生反应的离子方程式为 (5)酸性高锰酸钾溶液的浓度为 mol·L-1 III.探究乙二酸和高锰酸钾溶液反应时的速率变化 学习小组的同学发现.当向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时.溶液褪色总是先慢后快.即反应速率由小变大.为此.同学们做了如下的对比实验: 药品 H2C2O4(aq) KMnO4(H+)(aq) MnSO4(S) (g) 褪色时间 (S) C(mol·L-1) V(mL) C(mol·L-1) V(mL) 实验1 0.1 2 0.01 4 0 30 实验2 0.1 2 0.01 4 5 4 (6)同学们测出的褪色时间.是以下列哪个选项作为依据的 . A.从KMnO4溶液滴加到刚好接触H2C2O4溶液开始.溶液由紫红色变为近乎无色.半分钟之内不再出现紫红色为止. B.从KMnO4溶液滴加到刚好接触H2C2O4溶液开始.溶液由无色变为紫红色为止. C.从KMnO4溶液滴加到刚好接触H2C2O4溶液开始.溶液由紫红色变为近乎无色为止. (7)你认为溶液褪色先慢后快的原因是 .
网址:http://m.1010jiajiao.com/timu3_id_419952[举报]
乙二酸(HOOC-COOH)俗称“草酸”,常见的草酸是含有两分子结晶水的晶体.其主要物理常数如下:

某化学课外兴趣小组进行乙二酸性质的实验探究,回答下列问题:
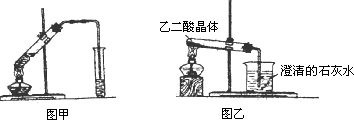
(1)在一大试管中加入3 mL乙二醇,然后边振荡试管边加入2 mL浓硫酸和2 mL乙二酸,按图甲连接好装置,小心加热3~5 min,产生的蒸气经导气管以通到饱和Na2CO3溶液的上方.
①反应中加入过量乙二醇的目的是________________________
②饱和Na2CO3溶液的作用是________________________
(2)已知劳动日酸分解的化学方程式为H2C2O4![]() H2O+CO↑+CO2↑.图乙是加热草酸晶体,验证草酸受热分解及其产物的实验装置图,但有人认为该装置不合理.请你根据草酸晶体的某些物理常数和实验目的,指出图中两种不合理的原因.
H2O+CO↑+CO2↑.图乙是加热草酸晶体,验证草酸受热分解及其产物的实验装置图,但有人认为该装置不合理.请你根据草酸晶体的某些物理常数和实验目的,指出图中两种不合理的原因.
________________________________________________
(3)某一草酸晶体的组成可表示为H2C2O4·XH2O,为了测定X的值,进行如下实验:
①准确称取W g草酸晶体,配成100 mL溶液;②取25.00 mL所酸草酸溶液于锥形瓶中,加入适量稀硫酸,用浓度为a mol/L的KMnO4溶液滴定至终点.重复上述滴定操作三次,实验数据记录如下表所示:
![]()
已知草酸与酸性高锰酸钾反应方程式:
H2C2O4+KMnO4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
①滴定终点溶液的颜色变化为________________
②X的值为________.