网址:http://m.1010jiajiao.com/timu3_id_419725[举报]
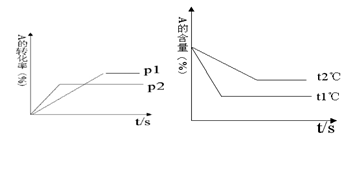
 2C(g) 该反应正反应为放热反应。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是
2C(g) 该反应正反应为放热反应。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:下列判断一定错误的是
B.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
C.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
D.图I研究的是压强对反应的影响,且乙的压强较高
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)= ;
(2)根据图示可确定x:y= ;
(3)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 K2(填“>”“=”或“<”)
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
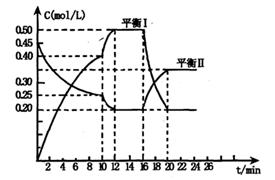
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)= ;
(2)根据图示可确定x:y= ;
(3)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 K2(填“>”“=”或“<”)
查看习题详情和答案>>
x A(g) +2B(s)
 y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题: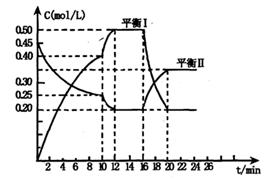
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)= ;
(2)根据图示可确定x:y= ;
(3)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 K2(填“>”“=”或“<”)
 CH3OH(g).
CH3OH(g).
 cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: