摘要:25. A.B.C.D.E是中学化学常见的五种元素.原子序数依次增大.其结构或性 质信息如下表: 元素 结构或性质信息 A 其原子最外层电子数是内层电子数的2倍 B 基态原子最外层电子排布为 C 非金属元素.其单质为固体.在氧气中燃烧时有明亮的蓝紫色火焰 D 单质在常温.常压下是气体.基态原子的M层上有1个未成对的P电子 E 其与A形成的合金为目的用量最多的金属材料 (1) E元素基态原子的电子排布式是 . (2) 在一定条件下.B与D可形成一种化合物 (分子中每个原子最外层均为8电子结构).常温下为淡黄色液体.该物质遇水强烈水解.生成两种产物.其中之一的分子构型为三角锥形.另一种产物具有漂白性.写出该化合物与水反应的化学方程式: . (3) E单质在海水中易发生电化学腐蚀.写出该电化学腐蚀的正极电极反应式 . (4) 己知1克单质C完全燃烧放出热量为Q KJ.写出表示C燃烧热的热化学方程式 . (5) 比较A与C的电负性:A C .A与D形成的一种常见化合物.常温下为液体.是良好的有机溶剂.其分子中含有的共价键类型是 .(填“键 或“键 ).
网址:http://m.1010jiajiao.com/timu3_id_419447[举报]
A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物.单质X、Y是生活中常见的金属,相关物质间的转化关系如图所示(部分反应物与产物已略去);
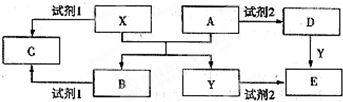
(1)若试剂1与试剂2不属于同类物质,则X与试剂1反应的离子方程式是
(2)若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是
①检验物质D的溶液中金属离子的实验操作是
②将物质C溶于水,其溶液呈
(3)若E溶液隔绝空气加热、蒸干后,可得到该溶液的溶质,工业上用E、稀硫酸和NaNO2为原料来制备高效净水剂Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
查看习题详情和答案>>

(1)若试剂1与试剂2不属于同类物质,则X与试剂1反应的离子方程式是
2Al+2H2O+2OH-=2AlO2-+3H2↑
2Al+2H2O+2OH-=2AlO2-+3H2↑
.(2)若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是
Fe2O3
Fe2O3
.①检验物质D的溶液中金属离子的实验操作是
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
.②将物质C溶于水,其溶液呈
酸性
酸性
(填“酸性”、“中性”或“碱性”),原因用离子方程来表示为Al3++3H2OAl(OH)3+3H+
Al3++3H2OAl(OH)3+3H+
.(3)若E溶液隔绝空气加热、蒸干后,可得到该溶液的溶质,工业上用E、稀硫酸和NaNO2为原料来制备高效净水剂Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
.A、B、C、D、E是中学化学常见单质,构成它们的元素的原子序数分别为a、b、c、d、е;且3(a+b)=2(a+c)=3(d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
(1)Y的电子式为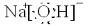
 ,构成E单质的元素的原子结构示意图为:
,构成E单质的元素的原子结构示意图为: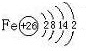
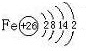 .
.
(2)反应③的离子方程式为
(3)E的氧化物与D在一定条件下反应的化学方程式为:
(4)已知常温下,1gA的单质与C的单质在点燃条件下完全反应,放出的热量为92.3kJ,写出W分解生成A和C的热化学方程式
(5)用离子方程式表示Z溶液显碱性的原因:
(6)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断N为
(7)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为
查看习题详情和答案>>

(1)Y的电子式为
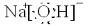
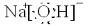
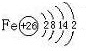
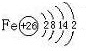
(2)反应③的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)E的氧化物与D在一定条件下反应的化学方程式为:
Fe2O3+2Al
2Fe+Al2O3
| ||
Fe2O3+2Al
2Fe+Al2O3
,在实验室中,引发该反应的实验操作为
| ||
将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条
将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条
.(4)已知常温下,1gA的单质与C的单质在点燃条件下完全反应,放出的热量为92.3kJ,写出W分解生成A和C的热化学方程式
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
.(5)用离子方程式表示Z溶液显碱性的原因:
AlO2-+2H2O?Al(OH)3+OH-
AlO2-+2H2O?Al(OH)3+OH-
.(6)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断N为
分子
分子
晶体.(7)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为
1:104
1:104
.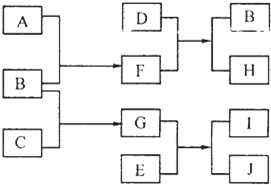 A、B、C、D、E是中学化学常见的单质,其中A、C常温下为气态,B、D、E是金属.E的摩尔质量是A的2倍,F、G、H、I、J五种化合物分别由组成上述五种单质中的两种元素组成.D与F反应放出大量的热.它们之间的转化关系如图所示(反应条件已省略);
A、B、C、D、E是中学化学常见的单质,其中A、C常温下为气态,B、D、E是金属.E的摩尔质量是A的2倍,F、G、H、I、J五种化合物分别由组成上述五种单质中的两种元素组成.D与F反应放出大量的热.它们之间的转化关系如图所示(反应条件已省略);请回答下列问题:
(1)元素B在周期表的位置是
(2)写出D与F反应的化学方程式:
(3)H是一种典型的
(4)若参加反应的E足量,生成的J中含有组成B的元素,则检验化合物J中阳离子的化学方法(有必要的文字叙述和相应的离子方程式)是:
A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子。它们之间可发生如下变化,且D与酸性氧化物、碱性氧化物均能反应。
A+B![]() C+D B+E=2D?
C+D B+E=2D?
(1)写出A的电子式______________。?
(2)写出B的化学式______________。?
(3)写出D的电子式______________。
查看习题详情和答案>>
A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子。它们之间可发生如下变化:A+B C+D,B+E
C+D,B+E 2D,且D与大多数酸性氧化物及碱性氧化物均能反应。
2D,且D与大多数酸性氧化物及碱性氧化物均能反应。
(1)写出A的电子式:______________,E的电子式:______________。
(2)B的化学式为______________,C的化学式为______________,D的化学式为______________,E的化学式为______________。
(3)用电子式表示D的形成过程:____________________________________________________。
查看习题详情和答案>>