网址:http://m.1010jiajiao.com/timu3_id_419434[举报]
 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.方法甲:取2药匙细小的硫酸铜晶体置于
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20ml浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
交流与讨论:
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是
| ||
| ||
| ||
| ||
(2)方法乙中,浓硫酸的作用是
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想
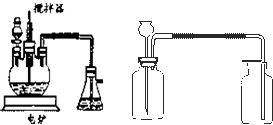
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4?5H2O 的新工艺.模拟制备装置如图所示.
问题一如图装置中,分液漏斗内装的液体是
问题二工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品----亚硝酸钙.尾气吸收生成亚硝酸钙的化学方程式是:
问题三将石灰乳稀释,可得到澄清石灰水. 澄清石灰水与CO2相遇能够产生白色沉淀.某同学想用如图所示装置以大理石和稀盐酸反应制取CO2.教师指出制取等量的气体,该装置需要太多的盐酸,造成浪费.该同学对该装置某部位加了一个小试管,解决了这个问题.请你把改进画在图中合适的位置.


 四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.
四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.(1)某种粗盐含有少量Ca2+、Mg2+、Fe3+、SO
2- 4 |
粗盐溶解
| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
提供的试剂有:a.饱和Na2CO3溶液 b.饱和K2CO3溶液
c.NaOH溶液 e.Ba(NO3)2溶液 d.BaCL2溶液
①欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO
2- 4 |
②蒸发时所用玻璃棒的作用是
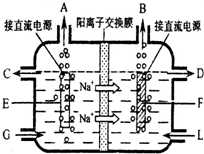
(2)食盐是工业上生产氯气和烧碱的重要原料.右图是工业上电解饱和和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).
①B处出口产生的物质是
| ||
| ||
②如果开始就将直流电源的正负极与电极接反了,通电几分钟,在电极F附近可以观察到的现象是
(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液.实验室在常温下电解饱和食盐水v1mL(密度为ρg/cm3),当收集到v2L标准状况下的H2时,理论上所得混合溶液中次氯酸钠的质量分数计算式为
| ||
ρV1-
|
| ||
ρV1-
|
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4?X H2O ,并测定该晶体中结晶水含量。请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响___ _(填“有”或“无”。其原因是_____________________________________________,该步实验的关键是保证 过量(填“硫酸”或“铁屑”)。
(2) FeSO4在不同温度下溶解度如下表所示:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
由于铁屑中含有C、Si等杂质,为了使FeSO4 溶液的浓度增大,便于反应后分离溶液和残渣。该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止_______________________________________________。你认为实验时的水浴温度最好控制在__________℃左右。从滤液中获得FeSO4?xH2O,下列操作中不需要的是 ( )
(A)冷却 (B)蒸发 (C)结晶
(D)洗涤 (E)过滤
(3) 以下是测定FeSO4?xH2O中结晶水含量的实验流程。(称量仪器为电子天平)
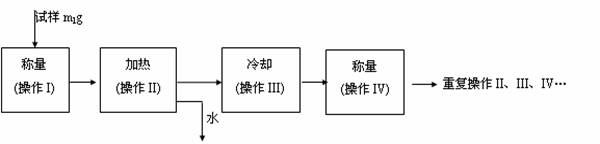
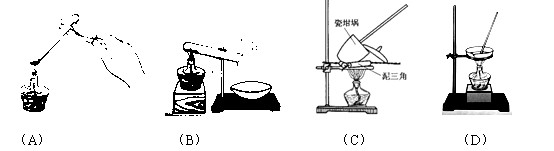
① 其加热装置正确的是( )
② 重复操作II、III、IV,直到连续两次称量结果相差不超过 g。
③ 操作III必须要在 中(填仪器名称)进行。
(4)以下结晶水含量测定操作正确的是( )
A、加热时,晶体溅出坩埚,再加些FeSO4?X H2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次。
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现 ;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气
查看习题详情和答案>>(10)按要求完成硝酸钾晶体的制备实验:
| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
| ① | 溶解 | 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 a 晶体析出。 |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 b 。 |
| ④ | 冷却 | 将滤液冷却至室温。 | 有晶体析出。 |
 ⑤ ⑤ | | 按有关要求进行操作 | 得到初产品硝酸钾晶体 |
| ⑥ | | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 | 得到纯度较高的硝酸钾晶体 |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。 |
(2)写出步骤③趁热过滤的目的 ,步骤⑥的操作名称 ,步骤⑦中产生白色沉淀的离子方程式
(3)步骤⑥的抽滤装置如图所示,仪器A的名称 ,该装置中的错误之处是 ;抽滤完毕或中途需停抽滤时,应先 ,然后 。
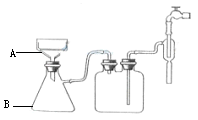 查看习题详情和答案>>
查看习题详情和答案>>
(10)按要求完成硝酸钾晶体的制备实验:
|
步骤 |
操作 |
具体操作步骤 |
现象解释结论等 |
|
① |
溶解 |
取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 |
固体溶解 |
|
② |
蒸发 |
继续加热搅拌,使溶液蒸发浓缩。 |
有 a 晶体析出。 |
|
③ |
热过滤 |
当溶液体积减少到约原来的一半时,迅速趁热过滤 |
滤液中的最主要成分为 b 。 |
|
④ |
冷却 |
将滤液冷却至室温。 |
有晶体析出。 |
|
|
|
按有关要求进行操作 |
得到初产品硝酸钾晶体 |
|
⑥ |
|
将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体 |
|
⑦ |
检验 |
分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 |
可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。 |
(1)把上述各步骤中的内容补充完整:a: b:
(2)写出步骤③趁热过滤的目的 ,步骤⑥的操作名称 ,步骤⑦中产生白色沉淀的离子方程式
(3)步骤⑥的抽滤装置如图所示,仪器A的名称 ,该装置中的错误之处是 ; 抽滤完毕或中途需停抽滤时,应先 ,然后 。
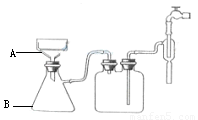
查看习题详情和答案>>
 ⑤
⑤