摘要:9.下列叙述正确的是( ). A.合成氨生产中将NH3液化分离.可加快正反应速率.提高H2的转化率 B.硫酸工业中.接触室中热交换器是利用SO3转化为H2SO4时放出的热量 C.氯碱工业采用离子交换膜法.可防止阳极室产生的Cl2进入阴极室 D.钢铁发生吸氧腐蚀时.阴极的反应式为:Fe-2e→Fe2+
网址:http://m.1010jiajiao.com/timu3_id_419341[举报]
下列叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:
OH-(aq)+H+(aq)=H2O(l) ∆H = -a kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
查看习题详情和答案>>
下列叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l) H = -a kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量可能比阴极析出铜的质量小
D.对于2HI(g)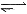 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
查看习题详情和答案>>
下列叙述正确的是
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为: OH-(aq)+H+(aq)=H2O(l) ?H =" -a" kJ·mol-1 |
| C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 |