网址:http://m.1010jiajiao.com/timu3_id_419093[举报]
(1)若增大N2的浓度,则化学反应速率
(2)若加入适当的催化剂,则化学反应速率
(3)若增大NH3的浓度,则化学反应速率
合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
A.容器内气体压强保持不变
B.容器内各物质的浓度不随时间变化
C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时
D.1个N≡N键断裂的同时,有3个H-H键形成
(2)达到平衡时,N2和H2的转化率分别为 ▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:
![]()
其中反应②为:4NO+3O2+2H2O![]() 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为 ▲ 。
查看习题详情和答案>>(10分)合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
A.容器内气体压强保持不变
B.容器内各物质的浓度不随时间变化
C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时
D.1个N≡N键断裂的同时,有3个H-H键形成
(2)达到平衡时,N2和H2的转化率分别为 ▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:
其中反应②为:4NO+3O2+2H2O4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为 ▲ 。
查看习题详情和答案>>
(10分)合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
| A.容器内气体压强保持不变 |
| B.容器内各物质的浓度不随时间变化 |
| C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时 |
| D.1个N≡N键断裂的同时,有3个H-H键形成 |
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:
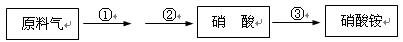
其中反应②为:4NO+3O2+2H2O
 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为 ▲ 。 查看习题详情和答案>>
(10分)合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
A.容器内气体压强保持不变
B.容器内各物质的浓度不随时间变化
C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时
D.1个N≡N键断裂的同时,有3个H-H键形成
(2)达到平衡时,N2和H2的转化率分别为 ▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:
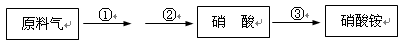
其中反应②为:4NO+3O2+2H2O 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为 ▲ 。
查看习题详情和答案>>