网址:http://m.1010jiajiao.com/timu3_id_418967[举报]
据报道, 有一种叫Thibacillus Ferroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿氧化成硫酸盐:
4CuFeS2 + 2H2SO4 + 17O2 = 4CuSO4 + 2Fe2(SO4)3 + 2H2O
(1) 利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
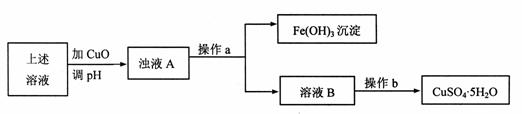
①溶液B显 (填“酸”、“碱”或“中”)性,原因是 (用离子方程式表示)。
②分析下表所提供的数据可知,加入CuO可除去CuSO4溶液中的Fe3+。
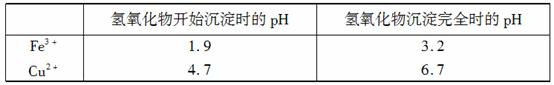
请运用沉淀溶解平衡的有关理论解释加入CuO能除去CuSO4溶液中Fe3+的原因:
③操作a的名称是 ,操作b的操作方法是 。
④检验溶液B中Fe3+是否被除尽的试剂是 ,证明Fe3+已被除尽的现象是 。
(2)在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案的化学方程式:
方案一:
方案二:
查看习题详情和答案>>4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是
(2)工业生产中利用上述反应后的溶液,按如下流程图1可制备胆矾(CuSO4?5H2O):
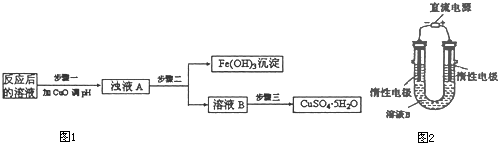
①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
②步骤三中的具体操作方法是
(3)有人提出可以利用图2的装置从溶液B中提炼金属铜.该过程中右边电极的反应式是
| ||
| ||
(4)工业上冶炼铜的方法之一为:Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+
| 1 |
| 2 |
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ?mol-1
③S(s)+O2(g)=SO2(g)△H=-296.8kJ?mol-1
则该法冶炼铜的反应中△H=
据报道,有一种叫Thibacillus Ferroxidans的细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐.发生的反应为:
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是______.
(2)工业生产中利用上述反应后的溶液,按如下流程图1可制备胆矾(CuSO4?5H2O):
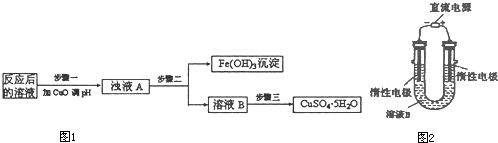
①分析下列表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
②步骤三中的具体操作方法是______.
(3)有人提出可以利用图2的装置从溶液B中提炼金属铜.该过程中右边电极的反应式是______,总反应的方程式是______.
(4)工业上冶炼铜的方法之一为:Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+
 O2(g)=Cu2O(s)△H=-12kJ?mol-1
O2(g)=Cu2O(s)△H=-12kJ?mol-1②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ?mol-1
③S(s)+O2(g)=SO2(g)△H=-296.8kJ?mol-1
则该法冶炼铜的反应中△H=______. 查看习题详情和答案>>
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是________。
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O)


②步骤三中的具体操作方法是____________________。
(3)有人提出可以利用如图的装置从溶液B中提炼金属铜。该过程中右边电极的反应式是____________,总反应方程式是____________________。

已知:
①2Cu(s)+1/2O2(g)=Cu2O(s) △H=-12 kJ/mol
②2Cu(s)+S(s)=Cu2S(s) △H=-79.5 kJ/mol
③S(s)+O2(g)=SO2(g) △H=-296.8 kJ/mol
则该法冶炼铜的反应中△H=________。
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3 +2H2O
(1)利用反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):

②分析下表所提供的数据可知,加入CuO可除去CuSO4溶液中的Fe3+。

③操作a的名称是____,操作b的操作方法是____。
④检验溶液B中Fe3+是否被除尽的试剂是____,证明Fe3+已被除尽的现象是____。
(2)在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成)。写出两种方案的化学方程式:方案一:____;方案二:____。