网址:http://m.1010jiajiao.com/timu3_id_41876[举报]
富马酸(HOOC-CH=CH-COOH)的性质:
| 分子式 | 相对分子质量 | 溶解度和溶解性 | 酸性 |
| H4C4O4 | 116 | 在水中:0.7g(25℃)、9.8g(97.5℃). 盐酸中:可溶. |
二元酸,且0.1mol/L H4C4O4的pH=2. |
| 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.6 |
①将适量的富马酸置于100mL烧杯中,加水20mL在热沸搅拌下,加入Na2CO3溶液10mL,使其pH为6.5~6.7;
②将上述溶液转移至100mL圆底烧瓶中,装好回流装置,加热至沸;
③缓慢加入新制的FeSO4溶液30mL,维持温度100℃,充分搅拌1.5小时.
④冷却、过滤,洗涤沉淀,然后水浴干燥,得到棕色粉末.
试回答:
步骤①中加入Na2CO3,反应的离子方程式
步骤①中反应后控制溶液pH为6.5~6.7;若反应后溶液的pH太小,则引起的后果是
Ⅱ、产品纯度测定
准确称取富血铁0.3200g,加煮沸过的3mol/LH2SO4溶液15mL,待样品完全溶解后,加煮沸过的冷水50mL和4滴邻二氮菲-亚铁指示剂,立即用(NH4)2Ce(SO4)3(硫酸高铈铵)0.1000mol/L标准溶液进行滴定.直至溶液刚好变为浅蓝色即为终点.测得其体积为18.50mL,计算样品中富血铁的质量分数,写出计算过程.(Fe2++Ce4+═Fe3++Ce3+)
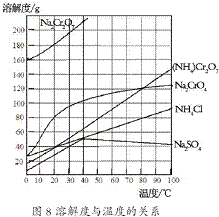 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:步骤1:将铬酸钠溶于适量的水,加入一定量浓硫酸酸化,使铬酸钠转化为重铬酸钠.
步骤2:将上述溶液蒸发结晶,并趁热过滤.
步骤3:将步骤二得到的晶体再溶解,再蒸发结晶并趁热过滤.
步骤4:将步骤三得到的滤液冷却至40℃左右进行结晶,用水洗涤,获得重铬酸钠晶体.
步骤5:将步骤四得到的重铬酸钠和氯化铵按物质的量之比1:2溶于适量的水,加热至105~110℃时,让其充分反应.
(1)步骤1是一个可逆反应,该反应的离子方程式为
(2)步骤2、3的主要目的是
(3)步骤4在40℃左右结晶,其主要目的是
(4)步骤5中获得(NH4)2Cr2O7还需补充的操作有
(5)(NH4)2Cr2O7受热分解制取Cr2O3的化学方程式为
(6)对上述产品进行检验和含量测定.
①检验产品中是否有K+,其操作方法及判断依据是
②为了测定上述产品中(NH4)2Cr2O7的含量,称取样品0.150g,置于锥形瓶中,加50mL水,再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为
2- 3 |
2- 6 |
(14分) 草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
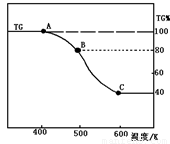
① 则A-B发生反应的化学方程式为: 。
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: 、
;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为: 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极 、负极 。
查看习题详情和答案>>
(14分) 草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A-B发生反应的化学方程式为: 。
② 精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: 、
;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为: 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极 、负极 。
查看习题详情和答案>>
(14分)草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。
①则A-B发生反应的化学方程式为: 。
②精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: 、
;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为: 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极 、负极 。