摘要: (1)1.88×10-4 mol·L-1·s-1 (2)5000 (3)CD (4)CD (5)N2H4(l) + 2H2O2(l) =N2(g) + 4H2O(g) △H = -641.63 kJ/mol
网址:http://m.1010jiajiao.com/timu3_id_418430[举报]
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
2CO2+N2.为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H
(2)前2s内的平均反应速率υ(N2)=
(3)在该温度下,反应的平衡常数表达式K=
.使平衡常数增大的方法是
A.升高温度 B.降低温度 C.增大体系压强 D.减小体系压强
E.增大反应物浓度 F.减小反应物浓度 G.减小生成物浓度 H.选择新的催化剂
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂;B.升高反应体系的温度
C.降低反应体系的温度;D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
请在上表空格中填入剩余的实验条件数据.
查看习题详情和答案>>
| 催化剂 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H
<
<
0(填写“>”、“<”、“=”).(2)前2s内的平均反应速率υ(N2)=
1.88×10-4 mol/(L.s)
1.88×10-4 mol/(L.s)
.(3)在该温度下,反应的平衡常数表达式K=
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
B
B
(填写选项)A.升高温度 B.降低温度 C.增大体系压强 D.减小体系压强
E.增大反应物浓度 F.减小反应物浓度 G.减小生成物浓度 H.选择新的催化剂
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
CD
CD
.A.选用更有效的催化剂;B.升高反应体系的温度
C.降低反应体系的温度;D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验 编号 |
T(℃) | NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 280 |
1.20×10-3 1.20×10-3 |
1.20×10-3 1.20×10-3 |
124 |
| Ⅲ | 350 | 5.80×10-3 5.80×10-3 |
5.80×10-3 5.80×10-3 |
124 |
(2011?上海模拟)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO
2CO2+N2+Q
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的Q
(2)前2s内的平均反应速率v (N2)=
(3)在该温度下,反应的平衡常数K=
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.
查看习题详情和答案>>
2NO+2CO
| ||
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间 | 0 | 1 | 2 | 4 | 4 | 5 |
| c(NO)(×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(NO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)在上述条件下反应能够自发进行,则反应的Q
>
>
0〔填写“>”、“<”、“=”〕(2)前2s内的平均反应速率v (N2)=
1.88×10-4 mol/(L?s)
1.88×10-4 mol/(L?s)
.(3)在该温度下,反应的平衡常数K=
5000
5000
.(只写出计算结果)(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
C、D
C、D
.A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比 表面积/m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |

(2009?浙江)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
2CO2+N2.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H
(2)前2s内的平均反应速率υ(N2)=
(3)在该温度下,反应的平衡常数K=
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
①请在上表空格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.

查看习题详情和答案>>
| 催化剂 |
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H
<
<
0(填写“>”、“<”、“=”).(2)前2s内的平均反应速率υ(N2)=
1.88×10-4mol?L-1?s-1
1.88×10-4mol?L-1?s-1
.(3)在该温度下,反应的平衡常数K=
5000
5000
.(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
C、D
C、D
.A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验 编号 |
T(℃) | NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 280 |
1.20×10-3 1.20×10-3 |
5.80×10-3 5.80×10-3 |
124 |
| Ⅲ | 350 | 1.20×10-3 1.20×10-3 |
5.80×10-3 5.80×10-3 |
124 |
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.

随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.
(1)钒主要用来制造钒钢.钒钢具有很高的耐磨损性和抗撞击性,原因是 (填序号)
A.钒在常温下,化学活泼性较弱
B.钒钢表面形成了致密且坚固的氧化膜
C.钒钢结构紧密,具有较高的韧性、弹性和强度
(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:
2VO43-+H2O?V2O74-+2OH-①
在温度较高时,焦钒酸盐又转化为偏钒酸盐:
V2O74-+H2O?2VO3-+2OH-②
反应②平衡常数的表达式K= ;
(3)已知某温度下:4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
写出H2还原V2O5得到V2O3的热化学方程式: ;
(4)用钒酸钠(Na3VO4)溶液(含PO43-、SiO32-等杂质离子)制备高纯V2O5流程如下: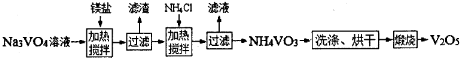
①加入镁盐,加热搅拌,其中加热的作用是 ;
②在25℃时,Ksp[Mg3(PO4)2]=1.0×10-26,若净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,则溶液中c(P043-)= ;
③加入NH4Cl,加热搅拌,该步骤反应的离子方程式为 ;
④为测定产品纯度,称取产品mg,溶解后定容在100mL容量瓶中,每次取5.00mL溶液于锥形瓶中,加入一定量的稀盐酸和KI溶液,用a mol?L-1Na2S2O3标准溶 液滴定,发生的反应为:
V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI
若三次滴定消耗标准溶液的平均体积为bmL,则该产品的纯度为 (用含m、a、b的代数式表示).
查看习题详情和答案>>
(1)钒主要用来制造钒钢.钒钢具有很高的耐磨损性和抗撞击性,原因是
A.钒在常温下,化学活泼性较弱
B.钒钢表面形成了致密且坚固的氧化膜
C.钒钢结构紧密,具有较高的韧性、弹性和强度
(2)在温度较低时,溶液中钒酸盐会转化为焦钒酸盐:
2VO43-+H2O?V2O74-+2OH-①
在温度较高时,焦钒酸盐又转化为偏钒酸盐:
V2O74-+H2O?2VO3-+2OH-②
反应②平衡常数的表达式K=
(3)已知某温度下:4V(s)+5O2(g)=2V2O5(s)△H=-1551kJ?mol-1
4V(s)+3O2(g)=2V2O3(s)△H=-1219kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
写出H2还原V2O5得到V2O3的热化学方程式:
(4)用钒酸钠(Na3VO4)溶液(含PO43-、SiO32-等杂质离子)制备高纯V2O5流程如下:

①加入镁盐,加热搅拌,其中加热的作用是
②在25℃时,Ksp[Mg3(PO4)2]=1.0×10-26,若净化后溶液中的Mg2+的平衡浓度为 1.0×10-4 mol?L-1,则溶液中c(P043-)=
③加入NH4Cl,加热搅拌,该步骤反应的离子方程式为
④为测定产品纯度,称取产品mg,溶解后定容在100mL容量瓶中,每次取5.00mL溶液于锥形瓶中,加入一定量的稀盐酸和KI溶液,用a mol?L-1Na2S2O3标准溶 液滴定,发生的反应为:
V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O
I2+2Na2S2O3=Na2S4O6+2NaI
若三次滴定消耗标准溶液的平均体积为bmL,则该产品的纯度为
以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶.
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤结晶.
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶.请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 而除去.
(2)①中加入的试剂应该选择 为宜.其原因是 .
(3)②中除去Fe3+所发生的总反应的离子方程式为 .
(4)下列与方案③相关的叙述中,正确的是 (填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
查看习题详情和答案>>
| 难溶电解质 | M(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×106 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶.
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤结晶.
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶.请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为
(2)①中加入的试剂应该选择
(3)②中除去Fe3+所发生的总反应的离子方程式为
(4)下列与方案③相关的叙述中,正确的是
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.