摘要:生成硫酸亚铁 在上述烧杯中加入10mL 3mol/L H2SO4溶液.让铁粉与硫酸充分反应.可用酒精灯微微加热.充分反应约20分钟.
网址:http://m.1010jiajiao.com/timu3_id_41814[举报]
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.《物质结构与性质》:原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36.已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
(1)X、Y、Z的电负性从大到小的顺序为
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输.已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示.
①W元素基态原子价电子排布式为
②已知CN-与
③上述沉淀溶解过程的化学方程式为
B.《化学实验》:无色晶体硫酸锌,俗称皓矾,在医疗上用作收敛剂,工业上作防腐剂、制造白色颜料(锌钡白)等.某实验小组欲用制氢废液制备硫酸锌晶体,进行了以下实验:
(1)取50mL制氢废液,过滤.除去不溶性杂质后,用ZnO调节滤液使pH约等于2,加热、蒸发、浓缩制得较高温度下的硫酸锌饱和溶液,冷却结晶,得到粗制的硫酸锌晶体.
①加入少量氧化锌调节滤液使pH≈2目的是
②加热蒸发、浓缩溶液时,应加热到
(2)粗晶体在烧杯中用适量蒸馏水溶解,滴加1~2滴稀硫酸,用沸水浴加热至晶体全部溶解.停止加热,让其自然冷却、结晶.抽滤(装置如图2所示).将所得晶体用少量无水乙醇洗涤1-2次,得到较纯的硫酸锌晶体.
①写出下列仪器的名称.a
②抽滤跟普通过滤相比,除了得到沉淀较干燥外,还有一个优点是
③用少量无水乙醇洗涤晶体的目的是
(3)在制取氢气时,如果锌粒中混有少量的铁、铜杂质,对硫酸锌的质量
查看习题详情和答案>>
A.《物质结构与性质》:原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36.已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
Al>Mg>Na
Al>Mg>Na
(用元素符号表示),元素Y的第一电离能大于Z的原因是Y的最外层电子排布处于全满稳定状态,能量降低
Y的最外层电子排布处于全满稳定状态,能量降低
.(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输.已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示.

①W元素基态原子价电子排布式为
3d64s2
3d64s2
.②已知CN-与
N2
N2
分子互为等电子体,1molCN-中π键数目为2NA
2NA
.③上述沉淀溶解过程的化学方程式为
Fe(CN)2+4KCN=K4[Fe(CN)6]
Fe(CN)2+4KCN=K4[Fe(CN)6]
.B.《化学实验》:无色晶体硫酸锌,俗称皓矾,在医疗上用作收敛剂,工业上作防腐剂、制造白色颜料(锌钡白)等.某实验小组欲用制氢废液制备硫酸锌晶体,进行了以下实验:
(1)取50mL制氢废液,过滤.除去不溶性杂质后,用ZnO调节滤液使pH约等于2,加热、蒸发、浓缩制得较高温度下的硫酸锌饱和溶液,冷却结晶,得到粗制的硫酸锌晶体.
①加入少量氧化锌调节滤液使pH≈2目的是
将硫酸转化成硫酸锌除去硫酸,且不带进其他杂质
将硫酸转化成硫酸锌除去硫酸,且不带进其他杂质
;②加热蒸发、浓缩溶液时,应加热到
溶液表面出现晶膜
溶液表面出现晶膜
时,停止加热.(2)粗晶体在烧杯中用适量蒸馏水溶解,滴加1~2滴稀硫酸,用沸水浴加热至晶体全部溶解.停止加热,让其自然冷却、结晶.抽滤(装置如图2所示).将所得晶体用少量无水乙醇洗涤1-2次,得到较纯的硫酸锌晶体.
①写出下列仪器的名称.a
布氏漏斗
布氏漏斗
;b吸滤瓶
吸滤瓶
.②抽滤跟普通过滤相比,除了得到沉淀较干燥外,还有一个优点是
过滤速度快
过滤速度快
.③用少量无水乙醇洗涤晶体的目的是
利用乙醇的挥发,除去晶体表面附着的水分,减少硫酸锌的损失
利用乙醇的挥发,除去晶体表面附着的水分,减少硫酸锌的损失
.(3)在制取氢气时,如果锌粒中混有少量的铁、铜杂质,对硫酸锌的质量
无
无
(填“有”、“无”)影响,原因是铜不与稀硫酸反应,过滤除去;铁虽然与稀硫酸反应生成硫酸亚铁,但锌比铁活泼,只要锌粒过量,就可置换硫酸亚铁中铁过滤除去
铜不与稀硫酸反应,过滤除去;铁虽然与稀硫酸反应生成硫酸亚铁,但锌比铁活泼,只要锌粒过量,就可置换硫酸亚铁中铁过滤除去
.
某同学创新设计制备氢氧化亚铁的实验方案:
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
(二)实验步骤及现象
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入 .向硫酸亚铁溶液中慢慢加入无水乙醇时,产生气泡的原因是 .某同学制备无水乙醇的方法是向无水乙醇(含乙醇的质量分数为99.5%以上)中加入一定量的氯化钙,然后蒸馏得到无水乙醇,你认为此方法能否得到无水乙醇? (填“能”或“否”).
(2)预测上述白色固体的成分可能是 ,保持白色的主要原因是 .
(3)写出生成白色沉淀的化学方程式: .
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:
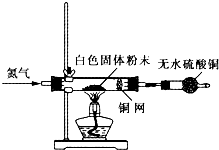
先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是 ,铜网的作用是 .
(5)证明白色固体粉末中含有+2价铁的实验现象为 :写出符合要求的方程式: .
属于分解反应的化学方程式: ;属于氧化还原反应的离子方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是 .
查看习题详情和答案>>
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入
(2)预测上述白色固体的成分可能是
(3)写出生成白色沉淀的化学方程式:
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:

先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是
(5)证明白色固体粉末中含有+2价铁的实验现象为
属于分解反应的化学方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁.其生产步骤如下:
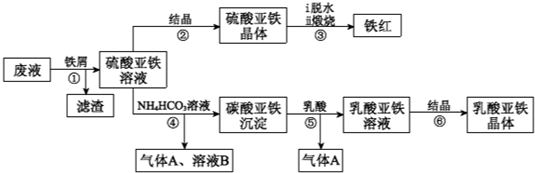
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-.请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、
(2)步骤④的离子方程式是
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因
(6)为测定步骤②中所得晶体中FeSO4?7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应).若消耗0.1000mol?L-1 KMnO4溶液20.00mL,所得晶体中FeSO4?7H2O的质量分数为(用a表示)
.
查看习题详情和答案>>

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-.请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是
玻璃棒、烧杯、漏斗
玻璃棒、烧杯、漏斗
.步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、
冷却结晶、过滤、洗涤、干燥
冷却结晶、过滤、洗涤、干燥
.(2)步骤④的离子方程式是
Fe2++2HCO3-=FeCO3↓+H2O+CO2↑
Fe2++2HCO3-=FeCO3↓+H2O+CO2↑
.(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及
防止Fe2+被氧化
防止Fe2+被氧化
.(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
1:4
1:4
.(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因
FeCO3(s)?Fe2+(aq)+CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液
FeCO3(s)?Fe2+(aq)+CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液
.(6)为测定步骤②中所得晶体中FeSO4?7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应).若消耗0.1000mol?L-1 KMnO4溶液20.00mL,所得晶体中FeSO4?7H2O的质量分数为(用a表示)
| 13.9 |
| a |
| 13.9 |
| a |
(2013?武清区三模)高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿(主要成分MnO2)制备高锰酸钾的一种工艺流程.
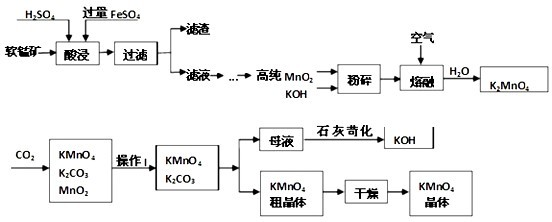
请回答:
(1)KMnO4稀溶液是一种常用的消毒剂.其消毒机理与
a.NaClO溶液 b.乙醛 c.双氧水 d.75%的酒精
(2)操作Ⅰ的名称是
(3)上述流程中可以循环使用的物质有
mol KMnO4.
(4)MnO2在酸性条件下具有强氧化性,可被还原为Mn2+.写出MnO2与浓盐酸制取氯气的化学方程式
为验证MnO2具有强氧化性,下列方案可行的是
A.MnO2固体加入到FeCl3溶液中,再加KSCN溶液,观察溶液是否变红
B.MnO2固体加入到Na2SO3溶液中,再加BaCl2溶液,观察是否有白色沉淀生成
C.MnO2固体加入到FeSO4与KSCN的酸性混合液中,观察溶液是否变红
(5)酸性KMnO4与H2C2O4溶液反应,反应开始时溶液褪色较慢,反应一段时间后褪色会迅速加快,其原因是
查看习题详情和答案>>

请回答:
(1)KMnO4稀溶液是一种常用的消毒剂.其消毒机理与
ac
ac
(填字母)相同.a.NaClO溶液 b.乙醛 c.双氧水 d.75%的酒精
(2)操作Ⅰ的名称是
过滤
过滤
;硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生主要反应的化学方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O
(3)上述流程中可以循环使用的物质有
KOH
KOH
和MnO2
MnO2
(填化学式).若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得| 2 |
| 3 |
| 2 |
| 3 |
(4)MnO2在酸性条件下具有强氧化性,可被还原为Mn2+.写出MnO2与浓盐酸制取氯气的化学方程式
MnO2+4HCl(浓)
MnCl2+Cl2 ↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2 ↑+2H2O
| ||
为验证MnO2具有强氧化性,下列方案可行的是
C
C
(填字母)A.MnO2固体加入到FeCl3溶液中,再加KSCN溶液,观察溶液是否变红
B.MnO2固体加入到Na2SO3溶液中,再加BaCl2溶液,观察是否有白色沉淀生成
C.MnO2固体加入到FeSO4与KSCN的酸性混合液中,观察溶液是否变红
(5)酸性KMnO4与H2C2O4溶液反应,反应开始时溶液褪色较慢,反应一段时间后褪色会迅速加快,其原因是
反应生成的Mn2+,起催化作用
反应生成的Mn2+,起催化作用
.硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2?6H2O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表
实验室欲制备硫酸亚铁铵晶体,设计了如下方案.
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去
②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为
③加入
(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a
②加热、浓缩溶液时,不浓缩至干的理由是
③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是
④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在
Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
Ⅲ) 判断该反应到达滴定终点的现象为
Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为
mol/L.
查看习题详情和答案>>
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去
铁屑表面的油污
铁屑表面的油污
,倒掉溶液,用蒸馏水把铁冲洗干净,干燥,备用;②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为
硫酸亚铁
硫酸亚铁
(填名称,不考虑水解),其物质的量约为0.045
0.045
mol;③加入
5.94
5.94
g硫酸铵到蒸发皿中,缓缓加热、浓缩至表面出现结晶膜为止、冷却,得硫酸亚铁铵晶体.(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a
过滤洗涤操作速度要快
过滤洗涤操作速度要快
;b步骤③要缓缓加热,避免沸腾
步骤③要缓缓加热,避免沸腾
;②加热、浓缩溶液时,不浓缩至干的理由是
因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解
因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解
;③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是
因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小
因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小
;④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在
酸式
酸式
(酸式或碱式)滴定管,操作时用右
右
手拿锥形瓶;Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
;Ⅲ) 判断该反应到达滴定终点的现象为
当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点
当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点
;Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为
| 1 |
| V |
| 1 |
| V |