网址:http://m.1010jiajiao.com/timu3_id_417739[举报]
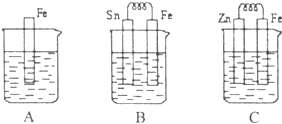 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.(1)A中反应的离子方程式为
(2)B中Sn极的电极反应式为
(3)C中被腐蚀的金属是
比较A、B、C中铁被腐蚀的速率,由 快到慢的顺序是
II.现有常温下的6份溶液:①0.01mol?L-1CH3COOH溶液;②0.01mol?L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01mol?L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01mol?L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液.
(1)其中水的电离程度最大的是
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为
(3)将溶液同等稀释10倍后溶液的pH:③
(12分)
Ⅰ.已知常温下,AgCl的Ksp=1.8×10-10,AgBr的Ksp=4.9×10-13。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则c(Cl-) (填“变大”、“变小”或“不变”,下同);
②若改加更多的AgCl固体,则c(Ag+) ;
③若改加更多的KBr固体,则c(Ag+) ,c(Cl-) ;
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是 ;
| A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大 |
| B.两种难溶盐电解质,其中Ksp小的溶解度也一定小 |
| C.难溶盐电解质的Ksp与温度有关 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
(1)以辛烷为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- -50e-==8CO2 + 9H2O,,正极的电极反应式为 。固体电解质里O2-的移动方向是 ,向外电路释放电子的电极是 。 查看习题详情和答案>>
有A、B、C、D四种强电解质,它们在水中电离可产生表中离子(每种物质只含一种阴离子且互不重复)。
|
阳离子 |
Na+、Ba2+、NH4+ |
阴离子 |
CO32-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,A、B的溶液中水的电离程度比纯水大,A、D焰色反应的火焰均为黄色;
②C溶液和D溶液相遇时只观察到有白色沉淀产生,B溶液和C溶液相遇时只观察到有刺激性气味的气体产生,A溶液和D溶液混合时无明显现象。请填写下列空白:
(1)A是___________,B是___________,C是____________,D是___________。
(2)常温,将1 ml pH =12的C溶液加水稀释至100ml,所得溶液中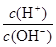 =
;
=
;
(3)常温下,0.15 mol·L-1的C溶液与0.20 mol·L-1盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比= _______________。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 。
查看习题详情和答案>>
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。将1.20 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法正确的是
A.反应后的固体混合物中还含有碳
B.反应后的固体混合物总质量为13.6 g
C.反应后的固体混合物中氧化物的物质的量为0.05 mol
D.反应后的固体混合物中单质Cu的质量为12.8 g
查看习题详情和答案>>
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。将1.20 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法正确的是
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物总质量为13.6 g |
| C.反应后的固体混合物中氧化物的物质的量为0.05 mol |
| D.反应后的固体混合物中单质Cu的质量为12.8 g |