摘要:1.A 2.B 3.D 4.C 5.D
网址:http://m.1010jiajiao.com/timu3_id_417737[举报]
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,在所有元素中A的原子半径最小,B原子最外层电子数是次外层的2倍.A、E同主族,D、F同主族,且D、F的原子序数之和为A、E的原子序数之和的2倍,请回答下列问题:
(1)写出下列元素的名称:C
(2)A、C能形成多种化合物,其中C2A4的结构式为
 (用元素符号回答,下同);
(用元素符号回答,下同);
(3)化合物E2D2中存在的化学键类型为
(4)由A、D、E、F四种元素形成的两种化合物,在水溶液中两者反应的离子方程式为
(5)B的单质可与A、D、F形成化合物的浓溶液反应,为检验所有生成物,被检验物质的顺序依次为
查看习题详情和答案>>
(1)写出下列元素的名称:C
氮
氮
;E钠
钠
;(2)A、C能形成多种化合物,其中C2A4的结构式为


(3)化合物E2D2中存在的化学键类型为
离子键、非极性键
离子键、非极性键
;(4)由A、D、E、F四种元素形成的两种化合物,在水溶液中两者反应的离子方程式为
H++HSO3-═H2O+SO2↑
H++HSO3-═H2O+SO2↑
;(5)B的单质可与A、D、F形成化合物的浓溶液反应,为检验所有生成物,被检验物质的顺序依次为
H2O、SO2、CO2
H2O、SO2、CO2
.A、B、C、D四种化合物,有的是药物,有的是香料.它们的结构简式如图所示: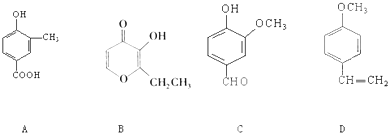
(1)化合物A的分子式是
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号)
(3)1mol D最多能与
(4)A与乙二醇以物质的量2:1反应生成一种酯,请写出该反应的化学方程式(注明反应条件):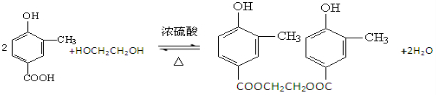

(5)写出A与NaHCO3溶液发生反应的化学方程式
 .
.
查看习题详情和答案>>

(1)化合物A的分子式是
C8H8O3
C8H8O3
;A中含有的官能团的名称是羟基、羧基
羟基、羧基
;(2)A、B、C、D四种化合物中互为同分异构体的是(填序号)
A、C
A、C
;(3)1mol D最多能与
4
4
mol的氢气发生加成反应;(4)A与乙二醇以物质的量2:1反应生成一种酯,请写出该反应的化学方程式(注明反应条件):


(5)写出A与NaHCO3溶液发生反应的化学方程式


A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性.下述为相关实验步骤和实验现象:
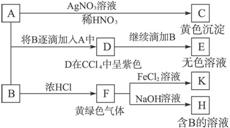
请回答:
(1)写出A、B和C的化学式:A
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式:
查看习题详情和答案>>

请回答:
(1)写出A、B和C的化学式:A
NaI
NaI
,BNaClO
NaClO
,CAgI
AgI
;(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
2I-+ClO-+H2O=I2+Cl-+2OH-
2I-+ClO-+H2O=I2+Cl-+2OH-
,I2+5ClO-+2OH-=2IO3-+5Cl-+H2O
I2+5ClO-+2OH-=2IO3-+5Cl-+H2O
;(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
;(4)写出由F→H的化学方程式:
Cl2+2NaOH=NaClO+NaCl+H2O
Cl2+2NaOH=NaClO+NaCl+H2O
.A、B、C、D四种化合物,有的是药物,有的是香料.它们的结构简式如下所示:
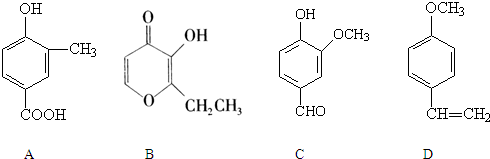
(1)化合物B的分子式是
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号)
(3)化合物B的核磁共振氢谱中出现
(4)1mol D最多能与
(5)A与乙二醇以物质的量2:1反应生成一种酯,请写出该反应的化学方程式(注明反应条件):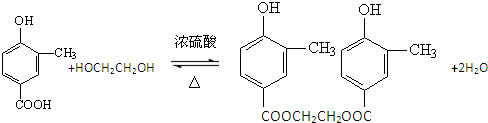
 .
.
查看习题详情和答案>>

(1)化合物B的分子式是
C7H8O3
C7H8O3
;A中含有的官能团的名称是羟基、羧基
羟基、羧基
;(2)A、B、C、D四种化合物中互为同分异构体的是(填序号)
AC
AC
;(3)化合物B的核磁共振氢谱中出现
5
5
组峰;(4)1mol D最多能与
4
4
mol的氢气发生加成反应;(5)A与乙二醇以物质的量2:1反应生成一种酯,请写出该反应的化学方程式(注明反应条件):


Ⅰ.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行实验:
由此判断:
(1)溶液中肯定不存在的离子有
溶液中肯定存在的离子是
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)
Ⅱ.已知一定量的铁粉与某浓度的硝酸反应,其离子方程式如下:
aFe+bH++cNO3-═dFe2++eFe3++fNO+gN2O4+hN2O+iH2O
试确定以下关系
(1)a、d、e的关系
(2)c、f、g、h的关系
(3)b、c、d、e的关系
(4)d、e、f、g、h的关系
(5)b、f、g、h的关系
查看习题详情和答案>>
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,测定溶液pH | pH=0 |
| (2)取少量该溶液加热浓缩,加Cu片和浓 H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加少量BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加足量AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
(1)溶液中肯定不存在的离子有
I-、Ba2+、Fe2+、HCO3-
I-、Ba2+、Fe2+、HCO3-
,溶液中肯定存在的离子是
NO3-、SO42- Mg2+、Al3+
NO3-、SO42- Mg2+、Al3+
.(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)
可能存在阴离子为氯离子,检验方法为:取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸银溶液,若出现白色沉淀则说明含有Cl-
可能存在阴离子为氯离子,检验方法为:取少许原溶液于试管中,先加入过量的硝酸钡溶液,再往上层清液中滴加硝酸银溶液,若出现白色沉淀则说明含有Cl-
Ⅱ.已知一定量的铁粉与某浓度的硝酸反应,其离子方程式如下:
aFe+bH++cNO3-═dFe2++eFe3++fNO+gN2O4+hN2O+iH2O
试确定以下关系
(1)a、d、e的关系
a=d+e
a=d+e
;(2)c、f、g、h的关系
c=f+2g+2h
c=f+2g+2h
;(3)b、c、d、e的关系
b+c=2d+3e
b+c=2d+3e
;(4)d、e、f、g、h的关系
2d+3e=3f+2g+8h
2d+3e=3f+2g+8h
;(5)b、f、g、h的关系
b=4f+4g+10h
b=4f+4g+10h
.