摘要:24.[化学--化学与技术] 海水中蕴藏着丰富的资源.海水综合利用的流程图如下. (1)用NaCl做原料可以得到多种产品. ①工业上由NaCl制备金属钠的化学方程式是 . ②实验室用惰性电极电解100mL0.1 mol/L NaCl溶液.若阴阳两极均得到112mL气体.则所得溶液的pH为 (忽略反应前后溶液的体积变化). ③电解氯化钠稀溶液可制备“84消毒液 .通电时氯气被溶液完全吸收.若所得消毒液仅含一种溶质.写出相应的化学方程式: . (2)分离出租盐后的卤水中蕴含着丰富的镁资源.经转化后可获得MgCl2粗产品. ①粗产品的溶液中含有..和.需将..转化为沉淀除去.Fe(OH)2呈絮状.常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).若只加一种上述(1)中得到的产品.该物质的化学式为 .控制溶液的pH为 . 物质 开始沉淀 沉淀完成 Fe(OH)3 2.7 3.7 Fe(OH)2 7.6 9.6 Mn(OH)2 8.3 9.8 Mg(OH)2 9.6 11.1 若只加一种上述(1)中得到的产品.该物质的化学式为 .控制溶液的pH为 . ②在家用电热水器不锈钢内胆表面镶嵌镁棒.利用电化学原理来防止内胆腐蚀.写出正极的电极反应式: .
网址:http://m.1010jiajiao.com/timu3_id_417323[举报]
【化学--选修2化学与技术】
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有 、 (填化学式).
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的 .
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使 ,而水的软化是 .
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为 ;电渗析法净化水时,使离子通过半透膜的推动力是 .
(5)某天然水中、c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L、c(HCO
)=8×10-4mol/L.要软化10m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g.
查看习题详情和答案>>
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为
(5)某天然水中、c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L、c(HCO
- 3 |
(2012?许昌三模)[化学--选修2:化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
A.风光秀丽的旅游城市
B.消耗硫酸甚多的工业城市
C.人口稠密的文化、商业中心城市
(2)写出沸腾炉内煅烧黄铁矿的化学方程式:
写出接触室中的化学方程式:
(3)CuFeS2是黄铜矿的主要成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是
A.黄铁矿煅烧前需要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)下表是压强对SO2平衡转化率的影响:
对于SO2转化为SO3的反应,增大压强可使转化率
(6)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化见下表:
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因:
查看习题详情和答案>>
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
C
C
的郊区.A.风光秀丽的旅游城市
B.消耗硫酸甚多的工业城市
C.人口稠密的文化、商业中心城市
(2)写出沸腾炉内煅烧黄铁矿的化学方程式:
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
;
| ||
写出接触室中的化学方程式:
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |
(3)CuFeS2是黄铜矿的主要成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为
4CuFeS2+13O2
4CuO+2Fe2O3+8SO2
| ||
4CuFeS2+13O2
4CuO+2Fe2O3+8SO2
.
| ||
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是
D
D
.A.黄铁矿煅烧前需要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)下表是压强对SO2平衡转化率的影响:
| 压强Mpa 转化率% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
增大
增大
,但在实际工业生产中常采用常压条件,理由是常压下SO2的转化率已很大
常压下SO2的转化率已很大
.(6)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化见下表:
| 沸腾炉温度 | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
SO2转化为SO3是正反应放热的可逆反应随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少)
SO2转化为SO3是正反应放热的可逆反应随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少)
.
【化学选修2-化学与技术】
工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式为 .
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是 (填化学式),原因是 .
(3)通入C和D气体后发生反应的化学方程式是 .
(4)④过滤后,向滤液中通入氨气,加入细小食盐颗粒,析出副产品 (填化学式),通氨气与加入细小食盐颗粒的作用是 .
(5)写出⑤煅烧发生反应的化学方程式: .产品纯碱中含有碳酸氢钠.若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数ω(NaHCO3)= (注明表达式中所用的有关符号的含义).
查看习题详情和答案>>
工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式为
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是
(3)通入C和D气体后发生反应的化学方程式是
(4)④过滤后,向滤液中通入氨气,加入细小食盐颗粒,析出副产品
(5)写出⑤煅烧发生反应的化学方程式:
(2011?宝鸡一模)[化学选修2--化学与技术]1892年,比利时人索尔维以NaCl、CO2、H2O为原料生产Na2CO3,叫索尔维法.其主要步骤是:
(1)在NH3饱和的NaCl液中通入CO2制得的NaHCO3;
(2)再将NaHCO3焙烧制得纯碱,CO2循环使用;
(3)析出小苏打的母液中加入生石灰,NH2循环使用.
1940年,我国著名化学家侯德榜先生冲破了“索尔维法”技术封锁,并加以改进,用NaCl固体代替生石灰;加入母液使NH4Cl晶体析出,生产出纯碱和氯化铵.这便是举世闻名的“侯氏制碱法”.
试回答:
(1)向母液通入氨气的目的和作用是
(2)在氨饱和NaCl溶液中通入CO2的两步反应方程式为
(3)不能在NaCl溶液中通入CO2制NaHCO3的原因是
(4)析出小苏打的母液中加入生石灰的反应方程式是
(5)“侯氏制碱法”与“索尔维法”相比较其优点是
查看习题详情和答案>>
(1)在NH3饱和的NaCl液中通入CO2制得的NaHCO3;
(2)再将NaHCO3焙烧制得纯碱,CO2循环使用;
(3)析出小苏打的母液中加入生石灰,NH2循环使用.
1940年,我国著名化学家侯德榜先生冲破了“索尔维法”技术封锁,并加以改进,用NaCl固体代替生石灰;加入母液使NH4Cl晶体析出,生产出纯碱和氯化铵.这便是举世闻名的“侯氏制碱法”.
试回答:
(1)向母液通入氨气的目的和作用是
增大二氧化碳的溶解度
增大二氧化碳的溶解度
.(2)在氨饱和NaCl溶液中通入CO2的两步反应方程式为
CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl
CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl
.(3)不能在NaCl溶液中通入CO2制NaHCO3的原因是
CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶
CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶
.(4)析出小苏打的母液中加入生石灰的反应方程式是
CaO+H2O=Ca(OH)2 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
CaO+H2O=Ca(OH)2 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
.(5)“侯氏制碱法”与“索尔维法”相比较其优点是
使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用
使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用
.(2012?石家庄一模)【化学一选修2:化学与技术】
现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下:
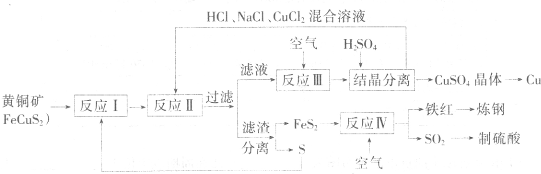
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
请回答:
(1)从黄铜矿冶炼粗铜的传统丁艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜、这种方法的缺点是
(2)反应Ⅰ的产物为(填化学式)
(3)反应Ⅲ的离子方程式为
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
(5)黄铜矿中Fe的化合价为+2,关于反应.8CuFeS2+21O2
8Cu+4FeO+2Fe2O4+16SO2下列说法正确的是
A.反应中被还原的元素只有氧
B.反应生成的SO2直接排放会污染环境
C.SO2既是氧化产物又是还原产物
D.当有8mol铜生成时,转移电子数目为100NA
(6)某硫酸厂为测定反应IV所得气体中SO2的体积分数,取280mL(已折箅成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L 的 K2Cr2O2标准溶液滴定至终点,消耗K2Cr2O3溶液25.00ml.
已知:Cr2O32-+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为
②反应Ⅳ所得气体中SO2的体积分数为
查看习题详情和答案>>
现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下:

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
请回答:
(1)从黄铜矿冶炼粗铜的传统丁艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜、这种方法的缺点是
反应有SO2生成,易造成环境污染,同时消耗大量热能.
反应有SO2生成,易造成环境污染,同时消耗大量热能.
(2)反应Ⅰ的产物为(填化学式)
CuS、FeS2
CuS、FeS2
(3)反应Ⅲ的离子方程式为
4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O
4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
该温度下,硫酸铜的溶解度小于氯化铜
该温度下,硫酸铜的溶解度小于氯化铜
(5)黄铜矿中Fe的化合价为+2,关于反应.8CuFeS2+21O2
| ||
BCD
BCD
(填选项字母)A.反应中被还原的元素只有氧
B.反应生成的SO2直接排放会污染环境
C.SO2既是氧化产物又是还原产物
D.当有8mol铜生成时,转移电子数目为100NA
(6)某硫酸厂为测定反应IV所得气体中SO2的体积分数,取280mL(已折箅成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L 的 K2Cr2O2标准溶液滴定至终点,消耗K2Cr2O3溶液25.00ml.
已知:Cr2O32-+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为
SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
,②反应Ⅳ所得气体中SO2的体积分数为
12.00%
12.00%
.