摘要:(1)加少量KClO3.插上镁条并将其点燃 Fe (2)Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O (3)Fe+2H+= Fe2++H2 Fe+2 Fe3+=3 Fe2+ (4)CMg2+=0.67mol/l C Fe2+ =2.3mol/l
网址:http://m.1010jiajiao.com/timu3_id_41730[举报]
如图表示各物质之间的转化关系.已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液.

请按要求填空:
(1)写出B的电子式:
(2)反应⑤的现象是
(3)反应①的化学反应方程式是
(4)反应⑥的离子方程式是
查看习题详情和答案>>

请按要求填空:
(1)写出B的电子式:
Na+[ ]2-Na+
]2-Na+
 ]2-Na+
]2-Na+Na+[ ]2-Na+
]2-Na+
. ]2-Na+
]2-Na+(2)反应⑤的现象是
迅速由白色变成灰绿色最终变为红褐色
迅速由白色变成灰绿色最终变为红褐色
.(3)反应①的化学反应方程式是
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
,在实验室引发反应④的操作是
| ||
在铝热剂上加少量KClO3,插上镁条并将其点燃
在铝热剂上加少量KClO3,插上镁条并将其点燃
.(4)反应⑥的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物.
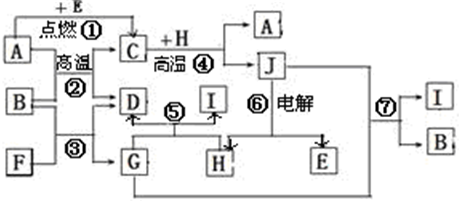
试回答下列有关问题:
(1)A在元素周期表的位置
(2)分别写出反应②⑦的化学方程式
(3)写出引发反应④的实验操作
(4)写出用A与H作电极材料插入G溶液形成闭合电路后的负极反应式是:
(5)写出上图中物质C与稀HNO3溶液反应的离子方程式:
查看习题详情和答案>>

试回答下列有关问题:
(1)A在元素周期表的位置
4
4
周期Ⅷ
Ⅷ
族.(2)分别写出反应②⑦的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
;
| ||
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
.(3)写出引发反应④的实验操作
加少量KClO3,插上镁条并将其点燃
加少量KClO3,插上镁条并将其点燃
;(4)写出用A与H作电极材料插入G溶液形成闭合电路后的负极反应式是:
Al-3e-+4OH-═AlO2-+2H2O
Al-3e-+4OH-═AlO2-+2H2O
.(5)写出上图中物质C与稀HNO3溶液反应的离子方程式:
3Fe3O4+NO3-+28H+═9Fe3++NO↑+14H2O
3Fe3O4+NO3-+28H+═9Fe3++NO↑+14H2O
.合理、高效利用金属矿物,将其中的金属从其化合物中还原出来用于生产和制造各种金属材料,这一过程在工业上称为金属的冶炼.
(1)以HgO为原料冶炼Hg,冶炼方法是
(2)铝热法是冶炼金属的方法之一,写出铝热法炼铁(Fe2O3)的化学方程式:
(3)某些金属氧化物粉末和铝粉在一定条件下可以发生铝热反应.下列反应速率(υ)和温度(T)的关系示意图中与铝热反应最接近的是:

查看习题详情和答案>>
(1)以HgO为原料冶炼Hg,冶炼方法是
加热分解法
加热分解法
.(2)铝热法是冶炼金属的方法之一,写出铝热法炼铁(Fe2O3)的化学方程式:
2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
 Al2O3+2Fe
Al2O3+2Fe2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
.引发铝热反应的实验操作是: Al2O3+2Fe
Al2O3+2Fe加少量KClO3,插上Mg条并将其点燃
加少量KClO3,插上Mg条并将其点燃
.(3)某些金属氧化物粉末和铝粉在一定条件下可以发生铝热反应.下列反应速率(υ)和温度(T)的关系示意图中与铝热反应最接近的是:
b
b
(填字母).
A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图.
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃);K为红棕色粉末.
请回答:
(1)I在G中燃烧时的现象为
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学方程式
(3)写出C与K反应的化学方程式
(4)J与H反应的离子方程式为
查看习题详情和答案>>

已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃);K为红棕色粉末.
请回答:
(1)I在G中燃烧时的现象为
火焰呈苍白色,并有白雾出现
火焰呈苍白色,并有白雾出现
.(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学方程式
2KCl+2H2O
2KOH+H2↑+Cl2↑
| ||
2KCl+2H2O
2KOH+H2↑+Cl2↑
.
| ||
(3)写出C与K反应的化学方程式
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
,引发该反应的操作为
| ||
在Al与Fe2O3混合物中加KClO3粉末,插上镁条,点燃镁条
在Al与Fe2O3混合物中加KClO3粉末,插上镁条,点燃镁条
.(4)J与H反应的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为1:8
1:8
.(2010?平顶山模拟)A-J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去).已知A是一种高熔点物质,D是一种红棕色固体.请回答下列问题:

(1)固体A的晶体类型为
(2)C与D在高温下的反应在冶金工业上称为
(3)G→J的化学方程式为
(4)A→H的离子方程式为
(5)I的水溶液pH
查看习题详情和答案>>

(1)固体A的晶体类型为
离子化合物
离子化合物
,K的化学式为Al(OH)3
Al(OH)3
.(2)C与D在高温下的反应在冶金工业上称为
铝热
铝热
反应,引发该反应的实验操作是在混合粉末上插上镁条,周围撒上少量KClO3,然后点燃镁条
在混合粉末上插上镁条,周围撒上少量KClO3,然后点燃镁条
.(3)G→J的化学方程式为
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(4)A→H的离子方程式为
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(5)I的水溶液pH
<
<
7(填“>”、“<”或“=”),原因是Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
(用离子方程式表示).