��Ŀ����
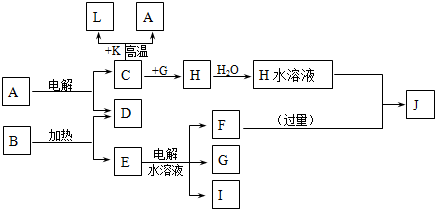
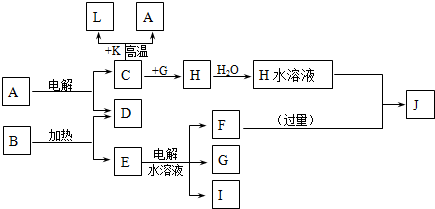
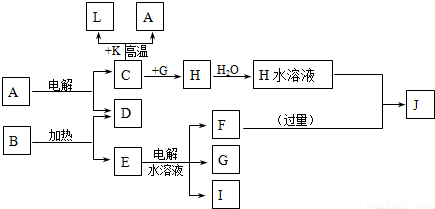
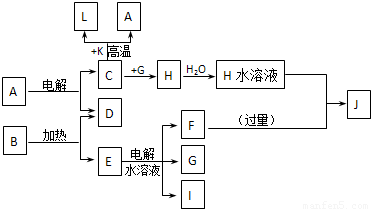
A��J�ֱ������ѧ��ѧ�г�����һ�ֵ��ʻ����ת����ϵ��ͼ��
��֪C��D��G��IΪ������Ԫ���γɵĵ��ʣ�D��G��I������Ϊ��̬����G Ϊ����ɫ���γ�D��Ԫ�ص�ԭ�������������Ǵ�����3����B����ɫ��Ӧ�г���ɫ������ɫ�ܲ�������KΪ����ɫ��ĩ��
��ش�
��1��I��G��ȼ��ʱ������Ϊ
��2��L��ĿǰӦ����㷺�Ľ�������̼����������L��������д�����Eˮ��Һ�Ļ�ѧ����ʽ
��3��д��C��K��Ӧ�Ļ�ѧ����ʽ
��4��J��H��Ӧ�����ӷ���ʽΪ

��֪C��D��G��IΪ������Ԫ���γɵĵ��ʣ�D��G��I������Ϊ��̬����G Ϊ����ɫ���γ�D��Ԫ�ص�ԭ�������������Ǵ�����3����B����ɫ��Ӧ�г���ɫ������ɫ�ܲ�������KΪ����ɫ��ĩ��
��ش�
��1��I��G��ȼ��ʱ������Ϊ
����ʲ�ɫ�����а�������
����ʲ�ɫ�����а�������
����2��L��ĿǰӦ����㷺�Ľ�������̼����������L��������д�����Eˮ��Һ�Ļ�ѧ����ʽ
2KCl+2H2O
2KOH+H2��+Cl2��
| ||
2KCl+2H2O
2KOH+H2��+Cl2��
��
| ||
��3��д��C��K��Ӧ�Ļ�ѧ����ʽ
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
�������÷�Ӧ�IJ���Ϊ
| ||
��Al��Fe2O3������м�KClO3��ĩ������þ������ȼþ��
��Al��Fe2O3������м�KClO3��ĩ������þ������ȼþ��
����4��J��H��Ӧ�����ӷ���ʽΪ
Al3++3AlO2-+6H2O=4Al��OH��3��
Al3++3AlO2-+6H2O=4Al��OH��3��
����������ת����ϵ��ÿһ����Ӧ��Ϊǡ�÷�Ӧ���Ҳ�����C+K��A+L�ı仯ʱ��Ϊ�����յõ�J����A��B�����ʵ���֮��Ϊ1��8
1��8
��������C��D��G��IΪ������Ԫ���γɵĵ��ʣ�D��G��I������Ϊ��̬����G Ϊ����ɫ�ж�ΪCl2���γ�D��Ԫ�ص�ԭ�������������Ǵ�����3���ƶ�Ϊ��Ԫ�أ�B����ɫ��Ӧ�г���ɫ������ɫ�ܲ�����˵�����м�Ԫ�أ�KΪ����ɫ��ĩ���ж�ΪFe2O3��L�dz������������ת����ϵ��C+K��Fe2O3��=L��Fe��+A��˵��CΪAl��AΪAl2O3��HΪAlCl3��ת����ϵE��ˮ��Һ���õ�F��G��Cl2����I��G��ȼ���ж�IΪH2�����ɵIJ���ΪHCl��B��������D��O2����E���ж�EΪKClO3��EΪKCl��FΪKOH��JΪNaAlO2�������ƶϳ��ĸ����ʻش����⣮
����⣺C��D��G��IΪ������Ԫ���γɵĵ��ʣ�D��G��I������Ϊ��̬����G Ϊ����ɫ�ж�ΪCl2���γ�D��Ԫ�ص�ԭ�������������Ǵ�����3���ƶ�Ϊ��Ԫ�أ�B����ɫ��Ӧ�г���ɫ������ɫ�ܲ�����˵�����м�Ԫ�أ�KΪ����ɫ��ĩ���ж�ΪFe2O3��L�dz������������ת����ϵ��C+K��Fe2O3��=L��Fe��+A��˵��CΪAl��AΪAl2O3��HΪAlCl3��ת����ϵE��ˮ��Һ���õ�F��G��Cl2����I��G��ȼ���ж�IΪH2�����ɵIJ���ΪHCl��B��������D��O2����E���ж�EΪKClO3��EΪKCl��FΪKOH��JΪNaAlO2��
��1��I��H2����G��Cl2����ȼ��ʱ�����Ȼ��⣬��ƿ���Ȼ�������ˮ�����γ�����СҺ�Σ���Ӧ������Ϊ������ʲ�ɫ�����а������֣��ʴ�Ϊ������ʲ�ɫ�����а������֣�
��2�������жϿ�֪��LΪFe�����E��KCl��ˮ��Һ�Ļ�ѧ����ʽΪ��2KCl+2H2O
2KOH+H2��+Cl2�����ʴ�Ϊ��2KCl+2H2O
2KOH+H2��+Cl2����
��3��C��Al����K��Fe2O3����Ӧ�����ȷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��2Al+Fe2O3
Al2O3+2Fe�����������ȷ�Ӧ�IJ���Ϊ����Al��Fe2O3������м�KClO3��ĩ������þ������ȼþ�����ʴ�Ϊ��2Al+Fe2O3
Al2O3+2Fe����Al��Fe2O3������м�KClO3��ĩ������þ������ȼþ����
��4��J��NaAlO2 ����H��AlCl3����Ӧ����˫ˮ�ⷴӦ����Ӧ�����ӷ���ʽΪ��Al3++3AlO2-+6H2O=4Al��OH��3������������ת����ϵ��ÿһ����Ӧ��Ϊǡ�÷�Ӧ���Ҳ�����C+K��A+L�ı仯ʱ��Ϊ�����յõ�J�������ķ�ӦΪ��Al2O3��2Al��2Al3+��KClO3��KCl��KOH���������Ӻ����������ط�Ӧ����JΪNaAlO2����Al3++4OH-=AlO2-�����ݷ�Ӧ��֪����ҪAl2O3��KClO3���ʵ���Ϊ1��8��Ӧ����NaAlO2���ʴ�Ϊ��1��8��
��1��I��H2����G��Cl2����ȼ��ʱ�����Ȼ��⣬��ƿ���Ȼ�������ˮ�����γ�����СҺ�Σ���Ӧ������Ϊ������ʲ�ɫ�����а������֣��ʴ�Ϊ������ʲ�ɫ�����а������֣�
��2�������жϿ�֪��LΪFe�����E��KCl��ˮ��Һ�Ļ�ѧ����ʽΪ��2KCl+2H2O
| ||
| ||
��3��C��Al����K��Fe2O3����Ӧ�����ȷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��2Al+Fe2O3
| ||
| ||
��4��J��NaAlO2 ����H��AlCl3����Ӧ����˫ˮ�ⷴӦ����Ӧ�����ӷ���ʽΪ��Al3++3AlO2-+6H2O=4Al��OH��3������������ת����ϵ��ÿһ����Ӧ��Ϊǡ�÷�Ӧ���Ҳ�����C+K��A+L�ı仯ʱ��Ϊ�����յõ�J�������ķ�ӦΪ��Al2O3��2Al��2Al3+��KClO3��KCl��KOH���������Ӻ����������ط�Ӧ����JΪNaAlO2����Al3++4OH-=AlO2-�����ݷ�Ӧ��֪����ҪAl2O3��KClO3���ʵ���Ϊ1��8��Ӧ����NaAlO2���ʴ�Ϊ��1��8��
���������⿼����ԭ�ӽṹ��Ԫ���жϣ�����ת����ϵ�������仯�������ʵ�Ӧ�ã���Ҫ����ʵ����������������Ȼ�����Һ������������ʣ����ȷ�Ӧ��ԭ���غ�ļ���Ӧ�ã�

��ϰ��ϵ�д�
�����Ŀ