网址:http://m.1010jiajiao.com/timu3_id_416900[举报]
反应I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
反应II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
(1)CH3OH (g)和H2(g)反应生成CH4(g)与H2O(g)的热化学方程式为
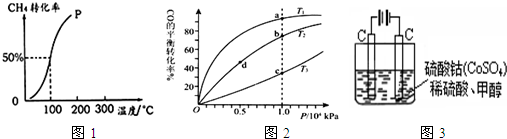
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为
②100℃时反应I的平衡常数为
③可用来判断该反应达到平衡状态的标志有
A.CO的含量保持不变
B.容器中CH4浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.3V正(CH4)=V逆(H2)
(3)按照反应II来生成甲醇,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1>T2>T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数:K(a)>K(c); K(b)=K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(4)工业上利用甲醇制备氢气的常用方法之一为:甲醇蒸汽重整法.该法中的一个主要反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图3装置模拟上述过程:
①写出阳极电极反应式
②写出除去甲醇的离子方程式
③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池负极的电极反应式为:
近年来,随着我国经济的快速发展,对电力的需求越来越高,这也促进了我国电力工业高速发展,但我国电力结构中,火电比重非常大,占发电装机总容量的75%以上,且火电比重还在逐年上升。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为: 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 (填字母代号)。

A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol·L-1
B.0~10min内,氢气的平均反应速率为0.075mol/(L·min)
C.达到平衡时,氢气的转化率为0.75
D.升高温度将使n(CH3OH)/n(CO2)减小
③甲醇碱性燃料电池工作时负极的电极反应式可表示为 。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为: 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为: ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。
查看习题详情和答案>>(14分)近年来,随着我国经济的快速发展,对电力的需求越来越高,这也促进了我国电力工业高速发展,但我国电力结构中,火电比重非常大,占发电装机总容量的75%以上,且火电比重还在逐年上升。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为: 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的ΔH3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 (填字母代号)。

A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol·L-1
B.0~10min内,氢气的平均反应速率为0.075mol/(L·min)
C.达到平衡时,氢气的转化率为0.75
D.升高温度将使n(CH3OH)/n(CO2)减小
③甲醇碱性燃料电池工作时负极的电极反应式可表示为 。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为: 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为: ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。
查看习题详情和答案>>
A.碘酒 B.青霉素 C.阿司匹林
D.葡萄糖注射液 E.抗酸药(主要成分为碳酸氢钠)
①上述药品中属于抗生素的是__________。(填字母,下同)
②能为人体直接提供能量的是__________。
③下列关于药物使用的说法中,正确的是________。
A.碘酒能使蛋白质变性,常用于外敷消毒
B.长期大量服用阿司匹林可预防疾病,没有毒副作用
C.使用青霉素,可直接静脉注射,不需进行皮肤敏感试验
D.随着平价药房的开设,生病了都可以到药店自己买药服用,不用到医院就诊
④碳酸氢钠可防治胃酸分泌过多,其发挥功效时的离子方程式为_________________。
(2)(5分)材料与社会生活密不可分。
①在下列材料中,属于无机非金属材料的是________(填字母)。
A.硬币 B.聚氯乙烯塑料 C.氮化硅陶瓷
②钢铁的生产与使用是人类文明和生活进步的一个重要标志。
工业炼铁的主要化学反应方程式为 。
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。试回答:铁锅的腐蚀主要是由________腐蚀造成的。为防止轮船的船体在海水中被腐蚀,一般在船身连接________(填“锌块”或“铜块”)。
(3)(6分)保持洁净安全的生存环境已成为全人类的共识。
①下列措施不利于改善环境质量的是________(填字母)。
A.在燃煤中添加石灰石粉末以减少酸雨的发生
B.为实现“低碳世博”,上海世博会很多展馆采用光电转化装置
C.对所有垃圾通过露天焚烧或深埋的方式进行处理
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
②对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 。
③居室装修所使用的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,免疫功能异常,该挥发性物质是 。
④获得洁净安全的饮用水是每个人的正常需要。
对饮用水常使用漂白粉或漂白精片进行杀菌消毒,漂白粉的有效成分为________。加入明矾起净水作用,写出Al3+水解的离子方程式: 。