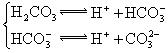摘要:26.对于弱酸.在一定温度下达到电离平衡时.各微粒的浓度存在一种定量的关系. 若25℃时有.则 式中:K为电离平衡常数.只与温度有关.[ ]为各微粒的平衡浓度.下表是几种常见弱酸的电离平衡常数 酸 电离方程式 电离平衡常数K 回答下列各问: (1)K只与温度有关.当温度升高时.K值 (填“增大 .“减小 .“不变 ). (2)在温度相同时.各弱酸的K值不同.那么K值的大小与酸性的相对强弱有何关系? . (3)若把.......都看作是酸.其中酸性最强的是 .最弱的是 . (4)多元弱酸是分步电离的.每一步都有相应的电离平衡常数.对于同一种多元弱酸的..之间存在着数量上的规律.此规律是 .产生此规律的原因是 . (5)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时.C mol/L的的电离数为a .试表示该温度下醋酸的电离平衡常数 .
网址:http://m.1010jiajiao.com/timu3_id_41633[举报]
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是几种常见弱酸的电离平衡常数(25℃).
回答下列问题:
(1)当升高温度时,K值
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律K1:K2:K3≈1:10-5:10-10,产生此规律的原因是
(5)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通到过量的碳酸钠溶液中
②在过量的氯水中滴入少量的碳酸钠溶液
查看习题详情和答案>>
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)当升高温度时,K值
变大
变大
,向各弱酸溶液中滴加少量NaOH溶液,K值不变
不变
(以上选填“变大”“变小”或“不变”).(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系
在相同条件下K值越大电离出的氢离子浓度越大,所以酸性越强
在相同条件下K值越大电离出的氢离子浓度越大,所以酸性越强
.(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是
H3PO4
H3PO4
,最弱的是HPO42-
HPO42-
.(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律K1:K2:K3≈1:10-5:10-10,产生此规律的原因是
上一级电离产生的H+对下一级电离有抑制作用
上一级电离产生的H+对下一级电离有抑制作用
.(5)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通到过量的碳酸钠溶液中
Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
;②在过量的氯水中滴入少量的碳酸钠溶液
2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO
2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO
.对于弱酸,在一定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系.若25℃时有HA 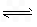 H++A-,则K=
H++A-,则K=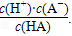 式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).
式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).
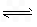 H++A-,则K=
H++A-,则K=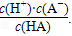 式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).
式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃). 
回答下列各题:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________,产生此规律的原因是________________________________________.
查看习题详情和答案>>
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________,产生此规律的原因是________________________________________.
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。如25℃时有HA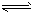 H++A-,则电离平衡常数
H++A-,则电离平衡常数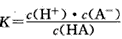 ,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。
,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。
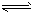 H++A-,则电离平衡常数
H++A-,则电离平衡常数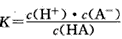 ,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。
,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。 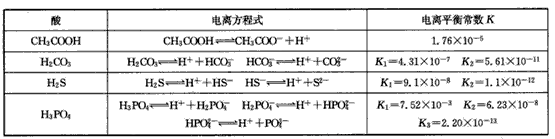
回答下列各题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱的关系是___
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是 ____,最弱的是____。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在 着数量上的规律,此规律是____,产生此规律的原因是________。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时cmol/L的CH3COOH的电离度为a(当弱电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子占原来总分子数的百分数叫做该电解质 的电离度)。试表示该温度下醋酸的电离平衡常数K=____。
查看习题详情和答案>>
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱的关系是___
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是 ____,最弱的是____。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在 着数量上的规律,此规律是____,产生此规律的原因是________。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时cmol/L的CH3COOH的电离度为a(当弱电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子占原来总分子数的百分数叫做该电解质 的电离度)。试表示该温度下醋酸的电离平衡常数K=____。
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25 ℃时,有
HA H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)
HA
 H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)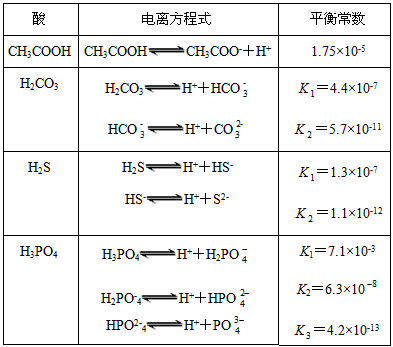
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是_______________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是__________,最弱的是__________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是__________,产生此规律的原因是___________________________。
查看习题详情和答案>>
(1)K只与温度有关,当温度升高时,K值__________(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱关系是_______________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是__________,最弱的是__________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是__________,产生此规律的原因是___________________________。